Nghiên cứu dựa trên nguyên liệu đầu vào là than thu được sau khi đã than hóa và tách SiO2 từ vỏ trấu đồng bằng Sông Hồng – Việt Nam với bề mặt riêng khoảng 521 m2/g…
Preparation and characterization of activated carbon from rice husk by Na2CO3 and K2CO3 activation
Nguyễn Văn Tư, Trịnh Văn Trung, Nguyễn Văn Thành
Viện Khoa Học & Kỹ thuật Vật liệu, Đại học Bách Khoa Hà Nội, Số 1 Đại Cồ Việt, Hà Nội
Ngày nhận bài: 6/1/2015, Ngày duyệt đăng: 8/2/2015
Tóm tắt
Nghiên cứu dựa trên nguyên liệu đầu vào là than thu được sau khi đã than hóa và tách SiO2 từ vỏ trấu đồng bằng Sông Hồng – Việt Nam với bề mặt riêng khoảng 521 m2/g. Quá trình hoạt hóa được tiến hành bằng cách sử dụng các chất hoạt tính là muối cacbonat Na2CO3 và K2CO3. Ảnh hưởng của nhiệt độ hoạt hóa, thời gian hoạt hóa và tỷ lệ khối lượng muối/than lên cấu trúc lỗ xốp và bề mặt riêng của than hoạt tính được nghiên cứu và khảo sát. Kết quả cho thấy đã tạo ra được than hoạt tính có cấu trúc xốp nano. Sử dụng muối Na2CO3, bề mặt riêng cao nhất đạt 1005 m2/g khi hoạt hóa ở 850 oC trong thời gian 1 giờ. Với muối K2CO3, kết quả tốt nhất thu được (bề mặt riêng đạt 1329 m2/g) khi xử lý ở 900 oC trong thời gian 2 giờ.
Từ khóa: than hoạt tính, hoạt tính hóa học, muối cacbonat, hấp phụ
Abstract
The study uses charcoal, which was obtained after carbonizing and removing silica of rice husk from the Red River Delta – Vietnam, as raw material. The Brunauer-Emmett-Teller (BET) specific surface area of charcoal is approximately 521 m2/g. The activated carbons were prepared with carbonate activation agents (K2CO3 and Na2CO3). The effect of various process parameters such as carbonization temperature and period as well as impregnation ratio on the characteristics of pores and BET surface area was evaluated. The results showed that nanostructured activated carbons were formed. For Na2CO3 activation, the activated carbon with the highest sur- face area of 1005 m2/g was obtained with Na2CO3 impregnation ratio of 13 wt% at 850 oC for 1 h. K2CO3 activa- tion produced the activated carbon with the highest surface area of 1329 m2/g with K2CO3 impregnation ratio of 10 wt% at 900 oC for 2 h.
Keywords: activated carbon; chemical activation; carbonate; adsorption
1. Đặt vấn đề
Than hoạt tính có thành phần chủ yếu là cacbon. Đặc điểm quan trọng của than hoạt tính là có thành phần cacbon cao, cấu trúc có độ xốp cao với kích thước lỗ xốp nhỏ nên bề mặt riêng lớn [1,2].
Nguyên liệu để chế tạo than hoạt tính trong nhiên cứu này có nguồn gốc từ vỏ trấu ở Việt Nam là loại nguyên liệu có trữ lượng lớn và hiện nay được coi là sản phẩm phụ của nông nghiệp. Một trong những khó khăn khi sử dụng vỏ trấu là nó chứa thành phần SiO2 cao. Các công trình nghiên cứu trước đây đã nghiên cứu việc than hóa và tách loại bỏ được tới 96% SiO2 [3,4]. Than thô thu được sau khi đã than hóa vỏ trấu và tách SiO2 có bề mặt riêng khoảng trên 500 m2/g sẽ được sử dụng làm nguyên liệu đầu vào cho các quá trình hoạt hóa nâng cao bề mặt riêng trong nghiên cứu này.
Về phương pháp hoạt hóa hiện nay có thể chia làm hai hướng: hoạt hóa bằng phương pháp vật lý (dùng CO2 hoặc hơi nước) và hoạt hóa bằng phương pháp hóa học (dùng KOH, NaOH, H3PO4 …) [1]. Phương pháp vật lý có ưu điểm là giá rẻ và dễ thực hiện nhưng tỷ lệ thu hồi than thấp, mất mát than nhiều, bề mặt riêng của than hoạt tính thu được không cao. Phương pháp hóa học có ưu điểm là tạo ra được bề mặt riêng cao. Trên thế giới hiện nay cho thấy hoạt hóa bằng KOH cho kết quả bề mặt riêng cao khoảng 2000 m2g-1. Tuy nhiên KOH không an toàn với con người và gây ảnh hưởng xấu đến môi trường. Việc sử dụng muối cacbonat an toàn hơn nên đã được lựa chọn làm chất hoạt tính trong nghiên cứu này.
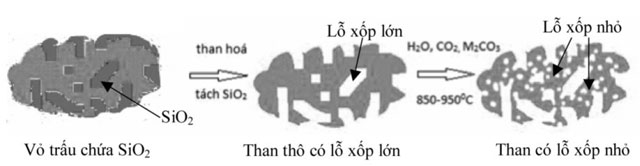
Hình 1 mô tả quá trình tạo cacbon hoạt tính có cấu trúc nano từ than trấu theo phương pháp top-down. Cụ thể, sau khi than hóa và tách SiO2 thì cấu trúc than đã có những lỗ xốp lớn nhất định. Tiếp theo, các tác nhân vật lý hay hóa học được sử dụng để tạo nên các lỗ xốp có kích thước nano để làm tăng bề mặt riêng của than. Lưu ý thêm rằng cấu trúc nano của than hoạt tính ở đây được thể hiện chủ yếu qua kích thước các lỗ xốp cỡ nano mà không phải là kích thước hạt than hoạt tính ở mức nano.
Trong quá trình hoạt hóa với muối cacbonnat, việc tạo lỗ xốp chủ yếu theo những phản ứng dưới đây [5]:
M2CO3 + 2C → 2M + 3CO (1)
M2CO3 → M2O + CO2 (2)
M2O + C → 2M + CO2 (3)
M2O + C → 2M + CO (4)
CO2 + C → 2CO (5)
Trong đó, M là kim loại kiềm như Na hoặc K.
Khi đạt nhiệt độ bắt đầu phân ly đáng kể (với Na2CO3 là khoảng 852 oC, còn K2CO3 là khoảng 894 oC [6]) thì phản ứng (5) đóng vai trò chủ yếu vào quá trình tạo lỗ xốp. Tại nhiệt độ phân ly của từng muối, áp suất riêng phần của khí CO2 sinh ra từ phản ứng phân hủy muối cacbonat K2CO3 và Na2CO3 lần lượt là 1,8 và 8 mmHg [6-8]. Khi đó, khí CO2 sẽ phản ứng (chủ yếu theo phản ứng (5)) theo xu hướng xâm nhập sâu vào các hạt than trấu để tạo than hoạt tính cấu trúc xốp nano với độ xốp lớn và bề mặt riêng cao.
Như vậy mục đích mà bài báo hướng tới là điều khiển áp suất riêng phần của khí CO2 bằng cách chủ động thay đổi loại muối hoạt tính, tỷ lệ muối, nhiệt độ hoạt hóa và thời gian hoạt hóa nhằm điều khiển phản ứng (5) để CO2 xâm nhập sâu vào bên trong hạt than chứ không phản ứng lan trên bề mặt, để làm giảm lượng mất mát than và tạo cấu trúc xốp nano cho than hoạt tính.
2. Thực nghiệm
Than đã được than hóa và tách SiO2 (sau này được gọi là than thô) được sấy khô ở nhiệt độ 100 oC trong 24 giờ. Muối K2CO3 và Na2CO3 với độ tinh khiết cao được được trộn đều và nghiền nhỏ đến kích thước khoảng (0,05 ÷ 0,1) mm. Sau đó mỗi lần nghiền trộn đều chỉ lấy 40 g dùng cho thí nghiệm trộn đều với muối trong máng nghiền bi theo tỷ lệ muối/than cần khảo sát. Hỗn hợp than và muối trộn đều được cho vào lò hoạt hóa, cung cấp khí N2 với lưu lượng 0,3 lít/phút. Nâng nhiệt tới nhiệt độ khảo sát và giữ nhiệt trong quá trình hoạt hóa (áp suất dư trong lò duy trì 74 mmHg). Nghiên cứu tiến hành trên hai loại muối cacbonat là Na2CO3 và K2CO3. Kí hiệu mẫu nghiên cứu: Xa.b.c, trong đó:
– X là tên kim loại đại diện cho loại muối hoạt tính (Na hoặc K)
– a là tỷ lệ muối/than (%). Giá trị khảo sát: 3, 6, 10, 13 và 18
– b là nhiệt độ hoạt hóa (oC). Giá trị khảo sát: 700, 800, 850, 900 và 950
– c là thời gian hoạt hóa (giờ). Giá trị khảo sát: 1, 2 và 3
Các vùng khảo sát được lựa chọn dựa trên cơ sở các nghiên cứu trước đây [3, 4] và một số tài liệu [1, 9]. Thành phần C (%) được xác định bằng phương pháp đốt. Hiệu suất thu hồi Hth được tính toán trên cơ sở khối lượng than trước và sau khi hoạt hóa. Hth = (ms/mt).100 %. Với, ms là khối lượng than sau xử lý, mt là khối lượng than trước xử lý hoạt hóa. Giá trị bề mặt riêng được xác định bằng phương pháp chuẩn độ Iốt.
3. Kết quả và thảo luận
Kết quả phân tích thành phần C (%), hiệu suất thu hồi than Hth và bề mặt riêng BET được trình bày ở bảng 1.
Bảng 1. Kết quả phân tích các mẫu sau hoạt hóa
| Mẫu | Kết quả phân tích | Mẫu | Kết quả phân tích | ||||
| C (%) | Hth (%) | BET (m2g-1) | C (%) | Hth(%) | BET (m2g-1) | ||
| Na3.900.2 | 89,4 | 80 | 614 | K3.900.2 | 88,2 | 85 | 918 |
| Na6.900.2 | 84,7 | 79 | 723 | K6. 900.2 | 87,6 | 82 | 987 |
| Na10.900.2 | 84,2 | 76 | 677 | K10. 900.2 | 84,6 | 81 | 1329 |
| Na13.900.2 | 83,3 | 74 | 754 | K13. 900.2 | 86,1 | 79 | 1284 |
| Na18.900.2 | 82,4 | 69 | 615 | K18. 900.2 | 76,4 | 76 | 994 |
| Na10.850.2 | 74,2 | 84 | 754 | K10.850.2 | 85,7 | 85 | 956 |
| Na10.900.1 | 82,6 | 84 | 794 | K10.900.1 | 84,1 | 83 | 1129 |
| Na10.900.3 | 86,1 | 65 | 614 | K10.900.3 | 87,2 | 70 | 919 |
| Na10.700.2 | 89,3 | 92 | 723 | K10.700.2 | 86,5 | 84 | 854 |
| Na10.800.2 | 83,5 | 84 | 834 | K10.800.2 | 84,4 | 85 | 888 |
| Na10.950.2 | 90,5 | 61 | 615 | K10.950.2 | 89,6 | 76 | 987 |
3.1. Ảnh hưởng của nồng độ chất hoạt tính (tỷ lệ muối/than)
Tỷ lệ muối/than ảnh hưởng trực tiếp tới số mol của các chất tham gia phản ứng hoạt hóa (phản ứng (1), (3) và (4)). Khi tăng tỷ lệ này lên thì lượng chất tham ra phản ứng tăng lên làm cho quá trình lấy các nguyên tử C khỏi bề mặt than và tạo lỗ xốp tăng lên, dẫn tới tăng giá trị BET. Nhưng nếu số mol chất hoạt tính tăng quá giá trị tối ưu nào đó thì quá trình phản ứng lại không tạo lỗ xốp sâu vào trong cấu trúc hạt than mà chỉ lấy C theo hướng lan trên bề mặt làm mở rộng lỗ xốp nên không những làm mất mát than cao (hiệu suất thu hồi thấp) mà còn làm giảm BET.
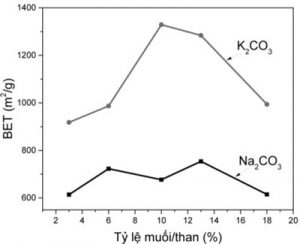
Hình 2 thể hiện sự ảnh hưởng của tỷ lệ muối/than tới bề mặt riêng của than sau hoạt hóa khi hoạt hóa ở 900 oC giữ nhiệt 2 giờ. Với muối K2CO3, khi tăng tỷ lệ muối/than thì giá trị BET tăng và đạt giá trị lớn nhất ở tỷ lệ 10%, sau đó sẽ giảm nếu tỷ lệ muối/than tiếp tục tăng lên. Do ở nhiệt độ cao và thời gian được giữ tới 2 giờ, áp suất phân ly của K2CO3 thích hợp để quá trình tạo lỗ xốp theo hướng xâm nhập sâu vào bên trong hạt than thô, phù hợp với ảnh tổ chức (hình 5a) có nhiều lỗ xốp nhỏ được tạo theo hướng xâm nhập sâu vào hạt than. Trong khi với muối Na2CO3 thì quá trình hoạt hóa không hiệu quả (giá trị BET thấp và không chênh lệch nhiều giữa các nồng độ). Quan sát ảnh SEM của mẫu Na10.900.2 ta thấy quá trình hoạt hóa làm bào mòn mạnh bề mặt tạo lỗ xốp lớn (hình 5b). Do ở nhiệt độ 900 oC áp suất phân ly của Na2CO3 đạt gần 10 mmHg [6] đồng thời thời gian hoạt hóa kéo dài làm cho phản ứng lan mạnh trên bề mặt, quá trình mất than nhiều nhưng hiệu quả hoạt hóa không cao. Kết quả này cũng phù hợp với hiệu suất thu hồi nêu trong bảng 1. Ví dụ, mẫu Na10.850.1 có hiệu suất thu hồi than 82 % trong khi mẫu Na10.900.2 chỉ có hiệu suất thu hồi 76 %.
3.2. Ảnh hưởng của thời gian hoạt hoá
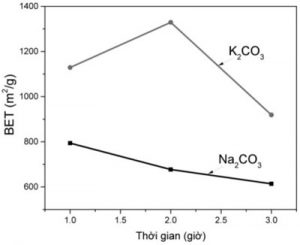
Hình 3 và bảng 1 thể hiện sự phụ thuộc của BET vào thời gian hoạt hóa. Kết quả với muối Na2CO3 ở 1 giờ thu được hiệu quả xử lý tốt nhất, trong khi muối K2CO3 xử lý hiệu quả ở 2 giờ. Khi thời gian được kéo dài lên 3 giờ thì BET của cả hai trường hợp đều giảm, thêm vào đó hiệu suất thu hồi cũng thấp hơn. Với muối Na2CO3 khi hoạt hóa ở các nhiệt độ 900 oC, cao hơn nhiệt độ bắt đầu phân ly (852 oC) của Na2CO3, thời gian hoạt hóa càng dài thì áp suất riêng phần của CO2 sinh ra ngày càng cao làm phản ứng (5) xảy ra càng mãnh liệt và chủ yếu lan trên bề mặt than nên làm giảm BET. Với muối K2CO3 tại nhiệt độ 900 oC áp suất phân ly đã đủ lớn do vậy ban đầu khi tăng thời gian từ 1 lên 2 giờ thì BET tăng nhưng khi thời gian hoạt hóa quá dài (3 giờ) thì phản ứng (5) cũng không còn xảy ra theo hướng xâm nhập sâu, mà đã lan trên bề mặt làm cho mất cấu trúc những lỗ xốp nano nhỏ tạo ra trước đó, dẫn tới làm giảm giá trị BET.
3.3. Ảnh hưởng của nhiệt độ hoạt hóa
Hình 4 và bảng 1 thể hiện sự phụ thuộc của BET vào nhiệt độ hoạt hóa. Với muối K2CO3, khi tăng nhiệt độ từ 700 lên 900 oC thì giá trị BET tăng.
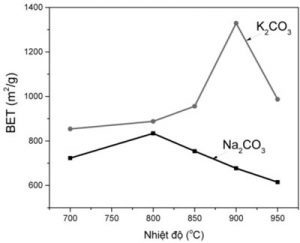
BET lớn nhất thu được tại 900 oC còn khi tăng lên 950 oC thì BET giảm xuống rõ rệt. Với muối Na2CO3, giá trị BET lớn nhất đạt được ở 800 oC. Dễ nhận thấy rằng BET của than hoạt tính thu được càng cao khi hoạt tính ở vùng nhiệt độ càng gần nhiệt độ phân ly của các muối (với Na2CO3 là khoảng 852 oC, còn K2CO3 là khoảng 894 oC). Có thể giải thích rằng khi ở gần nhiệt độ phân ly đáng kể quá trình hoạt hóa có hiệu quả do áp suất riêng phần của dòng khí CO2 phù hợp cho quá trình tạo lỗ xốp theo hướng xâm nhập sâu vào hạt than.
3.4. Ảnh hưởng của loại muối hoạt tính

Khi so sánh ở cùng chế độ (tỷ lệ muối/than, nhiệt độ và thời gian hoạt hóa) thì hầu hết các trường hợp hoạt hóa với muối K2CO3 đều có giá trị BET cao hơn so với muối Na2CO3. Nguyên nhân có thể do khi hoạt hóa thì áp suất riêng phần khí của khí CO2 sinh ra khi hoạt hóa bằng K2CO3 nhỏ hơn so với hoạt hóa bằng Na2CO3. Do vậy, CO2 sinh ra khi hoạt hóa bằng K2CO3 không lan trên bề mặt than mà xâm nhập sâu vào trong hạt than để tạo cấu trúc nano làm tăng BET của than. Khi đó, bề mặt than có các lỗ xốp loại trung bình (10÷40 nm) và lỗ xốp loại nhỏ (≈ 2 nm) phân bố đều trên bề mặt than (hình 5a). Còn khi hoạt hóa bằng Na2CO3 thì CO2 sinh ra nhiều lan trên bề mặt than dẫn đến hiệu ứng mất mát than lớn hơn mà độ xốp và bề mặt riêng lại không cao (bảng 1). Lỗ xốp khi đó có kích thước trung bình lớn ≈ 0,1 μm (hình 5b). Hiệu quả xử lý với muối K2CO3 tốt hơn Na2CO3 cũng phù hợp với những nghiên cứu của Kiyoshi Okada [9] về mối tương quan giữa kích thước nguyên tử kim loại kiềm của muối cacbonat và khả năng tạo lỗ xốp cho than hoạt tính, theo đó giá trị bề mặt riêng và thể tích lỗ xốp tăng theo chiều tăng bán kính ion kim loại kiềm theo thứ tự Li2CO3, Na2CO3, K2CO3, Rb2CO3 và Cs2CO3.
4. Kết luận
Xử lý hoạt hóa than bằng muối Na2CO3 thu được kết quả bề mặt riêng lớn nhất (990 m2/g) với mẫu Na13.850.1, lỗ xốp có kích thước lớn (≈ 0,1 μm), phân bố không đều, các lỗ xốp xuất hiện cục bộ trên bề mặt hạt than.
Các mẫu hoạt hóa với muối K2CO3 ở nhiệt độ 900 oC đều mang lại hiệu quả cao. Mẫu có bề mặt riêng lớn nhất thu được là K10.900.2 (bề mặt riêng đạt 1329 m2g-1). Lỗ xốp có kích thước nano với chủ yếu là lỗ xốp loại trung bình (10÷40 nm) và lỗ xốp loại nhỏ (≈ 2 nm) và phân bố đều trên hạt than.
Xử lý ở nhiệt độ quá cao (950 oC) và thời gian quá dài (3 giờ) không đem lại hiệu quả dẫn đến bề mặt riêng và hiệu suất thu hồi thấp. Xử lý hoạt hóa bằng muối K2CO3 có hiệu quả tốt hơn muối Na2CO3.
Tài liệu trích dẫn
- Hary Marsh and Francisco Rodriguez-Reinoso, Activated Carbon, Elsevier Science & Technology Books, 2006
- R. C. Bansal and M. Goyal, Activated Carbon Adsorption, CRC Press, USA, 2005
- Nguyễn Văn Tư và Vũ Văn Khánh, Nghiên cứu các yếu tố ảnh hưởng đến công nghệ chế tạo than thô từ trấu, Tạp chí KH&CN Kim loại, 45, 2012
- Taik Nam Kim, Nguyễn Văn Tư và Nguyễn Ngọc Minh, Nghiên cứu chế tạo than hoạt tính từ vỏ trấu Việt Nam, Tạp chí KH&CN Kim loại, 38, 2011
- B. Viswanathan, P. Indra Neel and T. K. Varadarajan, Methods of Activation and Specific Applications of Carbon Materials, National Centre for Catalysis Research Department of Chemisry, Indian Institute of Technology, Madras Chennai, India, 2009
- Nguyễn Đức Vận, Hóa học vô cơ (tập 2), Nhà xuất bản khoa học và kỹ thuật, Hà Nội, 2011
- G. J. Janz and M. R. Lorenz, Equilibrium Dissociation Pressures of Molten Lithium Carbonate, J. Chem. Eng. Data, 9, 1964, pp 94–95
- http://www.solvaychemicals.us/SiteCollectionDocuments/tds/HeatEffects_of_the_TronaSystem.pdf
- Kiyoshi Okada, Nohuo Yamamoto, Yoshikazu Kameshima and Atsuo Yasumor, Adsorption properties of acti- vated carbon from waste newspaper prepared by chemical and physical activation, Journal of Colloid and Interface Science, 262, 2003, pp 194–199
