Bài báo này trình bày quá trình hoàn nguyên titan đioxit Việt Nam để nhận được titan kim loại bằng phương pháp hoàn nguyên nhiệt magie-canxi. Magie và canxi có mặt đồng thời trong hỗn hợp chất hoàn nguyên theo một tỷ lệ nhất định. Nghiên cứu thực hiện ở quy mô phòng thí nghiệm.
Reduction process of titanium metal from Vietnam’s TiO2 by thermic method, using calcium and magnesium as reduction mixture
Ngô Xuân Hùng, Đặng Văn Hảo, Lê Thị Chiều
Viện Khoa học và kỹ thuật vật liệu, trường Đại học Bách khoa Hà Nội
Ngày nhận bài: 10/1/2015, Ngày duyệt đăng: 8/2/2015
Tóm tắt
Bài báo giới thiệu quá trình chế tạo titan kim loại bằng cách hoàn nguyên titan đioxit Việt Nam sử dụng hỗn hợp magiê và canxi. Các tính toán nhiệt động học cho thấy trong khoảng nhiệt độ từ 400 đến 800 oC Mg và Ca đều có khả năng hoàn nguyên Ti từ TiO2. Tuy nhiên, nếu sử dụng đồng thời cả hai nguyên tố hoàn nguyên, thì bắt đầu từ 446 oC, hỗn hợp đã có pha lỏng. Khi nhiệt độ lớn hơn 700 oC hỗn hợp là một pha lỏng đồng nhất. Do đó, phản ứng hoàn nguyên giữa TiO2 và hỗn hợp xảy ra ở trạng thái bán lỏng với tốc độ lớn hơn so với khi sử dụng từng nguyên tố riêng rẽ. Các thí nghiệm hoàn nguyên TiO2 bằng phương pháp nhiệt hỗn hợp (Mg+Ca) thực hiện trong thời gian hoàn nguyên là 2 giờ, với lượng (Mg+Ca)thực tế = 120 % giá trị lý thuyết. Sản phẩm thu được đạt 94 % Ti. Hiệu suất hoàn nguyên đạt mức cao nhất khi nhiệt độ là 850 oC. Sử dụng chất hoàn nguyên là hỗn hợp Mg và Ca sẽ tiết kiệm chi phí rất nhiều so với sử dụng 100 % Ca làm chất hoàn nguyên.
Từ khóa: titan, titan dioxit, canxi, magiê.
Abstract
This paper presents the preparation process of Ti metal from Vietnam TiO2 using a reduction mixture of Mg and Ca. Thermodynamic calculations show that in the temperature range of (400÷800) oC Mg and Ca are capable to reduce Ti from TiO2. However, if both elements are used in one mixture, then starting from 446 oC, a liquid phase appears in this mixture. When the temperature is higher than 700 °C the mixture is a homogenous liquid phase. Therefore, the reaction between TiO2 and the mixture occurs in a semi-solid state with a greater speed in comparison with case of each reduction element. The reduction experiments of TiO2 by thermic (Mg+Ca) mixture method are perfomed for 2 hours, with the (Mg+Ca) mixture of 120 % theoretical value. Products obtained are of 94 % Ti. The effect of reduction is the highest at temperature of 850 oC. The use of the (Mg+Ca) mixture as reducing agent will lower total cost and is better than use of 100 % Ca agent.
Keywords: titanium, titanium dioxide, calcium, magnesium.
1. Đặt vấn đề
Việt Nam là một trong những nước có trữ lượng titan lớn trên thế giới. Quặng titan tập trung chủ yếu dọc ven biển các tỉnh Thanh Hóa, Hà Tĩnh, Quảng Bình, Quảng Trị, Thừa Thiên – Huế, Bình Định, Bình Thuận [1]. Gần đây, một số cơ quan nghiên cứu và các trường đại học, các nhà khoa học đã nghiên cứu và bước đầu sản xuất thành công titan đioxit, nano titan đioxit từ quặng trong nước và sản phẩm đã được ứng dụng trong công nghệ diệt khuẩn, bảo vệ môi trường hoặc làm pigmen, tuy nhiên chúng ta chưa tiến hành nghiên cứu và sản xuất titan kim loại. Vì vậy mặc dù có nguồn quặng phong phú nhưng cho đến nay mọi nhu cầu về titan kim loại và hợp kim titan đều phải nhập khẩu. Có thể thấy rõ là việc nghiên cứu sản xuất titan kim loại từ tài nguyên nước nhà là một nhu cầu bức thiết. Nghiên cứu này thực hiện nhằm góp phần đáp ứng nhu cầu đó [1, 2].
1.1. Mục tiêu nghiên cứu
Quy trình sản xuất Ti kim loại phổ biến trên thế giới là quy trình Kroll. Theo quy trình đó, Ti kim loại được sản xuất từ TiCl4. Từ năm 1950 các nhà sản xuất Ti luôn tìm kiếm một quy trình sản xuất dễ hơn, rẻ hơn. Có thể ví dụ: hoàn nguyên titan đioxit bằng phương pháp nhiệt magie đạt mức hoàn nguyên 92 %, hoàn nguyên bằng Ca hiệu suất cao hơn nhưng đắt hơn nhiều so với hoàn nguyên bằng Mg. Một số nhà nghiên cứu đã tiến hành hoàn nguyên kết hợp hai phương pháp trên gồm hai bước: trước tiên bằng Mg, bước tiếp theo sau là hoàn nguyên bằng canxi, với quy trình này, các nhà sản xuất titan Nhật Bản đã đạt được mức độ hoàn nguyên với lượng oxy nhỏ hơn 2 % [3].
Bài báo này trình bày quá trình hoàn nguyên titan đioxit Việt Nam để nhận được titan kim loại bằng phương pháp hoàn nguyên nhiệt magie-canxi. Magie và canxi có mặt đồng thời trong hỗn hợp chất hoàn nguyên theo một tỷ lệ nhất định. Nghiên cứu thực hiện ở quy mô phòng thí nghiệm.
1.2. Nhiệt động học của quá trình [4]
Canxi và magie có thể hoàn nguyên titan đioxit thành titan kim loại, sự hoàn nguyên nhiệt magie và canxi có thể được biểu diễn theo phương trình:
TiO2 + 2Ca = Ti + 2CaO (1)
TiO2 + 2Mg = Ti + 2MgO (2)
Các phản ứng trên chỉ có thể xảy ra khi điều kiện nhiệt động học cho phép, vì vậy trước khi thí nghiệm, cần tính toán nhiệt động học cho quá trình.
a. Hoàn nguyên bằng nhiệt Ca
Dưới đây nêu kết quả tính các thông số nhiệt động học (ΔG và lnKp) cho phản ứng (1) trong các vùng nhiệt độ khác nhau (bảng 1, hình 1).
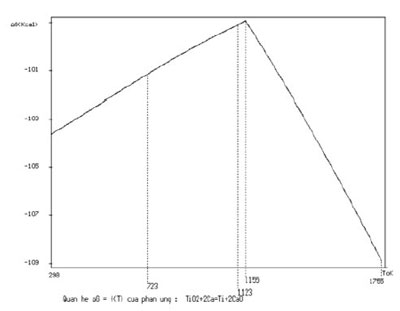
* Trong khoảng nhiệt độ: (773 – 1123) K chất tham gia của phản ứng tồn tại ở trạng thái như sau: (TiO2 – rắn) + (Ca – rắn) + (Ti – rắn) + (CaO – rắn)
ΔG = – 103509,43 + 5,30 TlnT – 4,56(E-3)T*T – 0,83(E+5)/T – 28,18T
* Tương tự khoảng nhiệt độ: (1123 – 1155) K
(TiO2 – rắn) + (Ca – lỏng) + (Ti – rắn) + (CaO – rắn)
ΔG = – 104362,76 + 7,52TlnT – 5,96(E-3)T*T – 0,83(E+5)/T – 41,44T
* Khoảng nhiệt độ: (1155 – 1755) K
(TiO2 – rắn) + (Ca – lỏng) + (Ti – rắn) + (CaO – rắn)
ΔG = – 82709,97 + 5,27TlnT – 4,90(E-3)T*T – 1,14(E+5)/T – 45,52T
Bảng 1. Giá trị tính ΔG và lnKp
| Nhiệt độ ( oC) | (K) | ΔG (cal) | lnKp |
| 500 | 773 | – 100878 | 65,66 |
| 600 | 873 | – 100347 | 57,84 |
| 700 | 973 | – 99848 | 51,63 |
| 800 | 1073 | – 99388 | 46,61 |
| 882 | 1155 | – 98998 | 43,13 |
| 900 | 1173 | – 99257 | 42,58 |
| 1000 | 1273 | – 100726 | 39,81 |
| 1100 | 1373 | – 102253 | 37,47 |
| 1200 | 1473 | – 103841 | 35,47 |
| 1300 | 1573 | – 105492 | 33,74 |
| 1400 | 1673 | – 107207 | 32,24 |
Giá trị ΔG của phản ứng (1) hoàn nguyên TiO2 bằng Ca kim loại ở 400 oC từ – 101,4 tới – 99 kcal/mol. Khi nhiệt độ tăng lên đến 882 oC có chuyển pha từ α Ti sang β Ti. Sau đó nếu tiếp tục tăng nhiệt độ, ΔG của phản ứng lại giảm tới -107 kcal/mol khi nhiệt độ đạt 1400 oC.
b. Hoàn nguyên bằng nhiệt Mg
Tương tự sẽ tính các thông số nhiệt động học (ΔG và lnKp) cho phản ứng (2) trong 4 vùng nhiệt độ (bảng 2, hình 2).
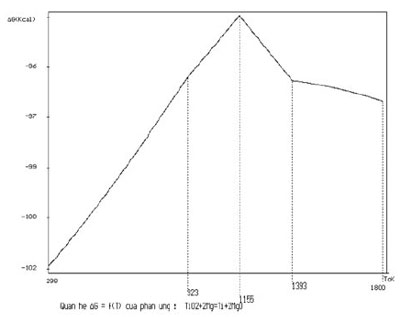
* Khoảng nhiệt độ: (298 – 923) K, chất tham gia của phản ứng tồn tại ở trạng thái như sau:
(TiO2 – rắn) + (Mg – rắn) + (Ti – rắn) + (MgO – rắn)
ΔG = – 103455,39 + 1,66TlnT + 0,13(E-3)T*T + 0,12(E+5)/T – 3,64T
* Khoảng nhiệt độ: (923 – 1155) K
(TiO2 – rắn) + (Mg – lỏng) + (Ti – rắn) + (MgO – rắn)
ΔG = – 98636,24 + 7,00TlnT – 2,32(E-3)T*T + 0,22(E+5)/T – 43,07T
* Khoảng nhiệt độ: (1155 – 1393) K
(TiO2 – rắn) + (Mg – lỏng) + (Ti – rắn) + (MgO – rắn)
ΔG = – 81236,53 + 4,75TlnT – 1,26(E-3)T*T – 0,09(E+5)/T – 43,47T
* Khoảng nhiệt độ: (1393 -1800) K
(TiO2 – rắn) + (Mg – khí) + (Ti – rắn) + (MgO – rắn)
ΔG = – 99485,44 – 1,31TlnT – 1,26(E-3)T*T – 0,09(E+5)/T + 13,50T
| Nhiệt độ ( oC) | (K) | ΔG (cal) | lnKp |
| 400 | 673 | – 98551 | 73,68 |
| 500 | 773 | – 97640 | 63,56 |
| 600 | 873 | – 96703 | 55,74 |
| 700 | 973 | – 95852 | 49,57 |
| 800 | 1073 | – 95084 | 44,59 |
| 900 | 1173 | – 94586 | 40,57 |
| 882 | 1155 | – 94440 | 41,14 |
| 1000 | 1273 | – 95388 | 37,70 |
| 1100 | 1373 | – 96178 | 35,25 |
| 1200 | 1473 | – 96409 | 32,93 |
| 1300 | 1573 | – 96532 | 30,88 |
| 1400 | 1673 | – 96689 | 29,08 |
Bảng 2. Giá trị tính ΔG và lnKp
Giá trị ΔG của phản ứng (2) hoàn nguyên TiO2 bằng Mg kim loại ở 400 oC từ -98,5 tới -94,4 kcal/mol. Khi nhiệt độ tăng lên đến nhiệt độ 882 oC có chuyển pha từ α Ti sang β Ti. Sau đó khi nhiệt độ tiếp tục tăng, ΔG của phản ứng lại giảm tới -96,6 kcal/mol khi nhiệt độ đạt 1400 oC.
Giá trị lớn nhất của ΔG khi hoàn nguyên bằng Mg kim loại lớn hơn khi hoàn nguyên bằng Ca kim loại là 4,6 kcal/mol. Khả năng hoàn nguyên bằng Mg kém hơn so với Ca. Nhưng cho dù có kém hơn, giá trị ΔG khi hoàn nguyên TiO2 bằng Mg vẫn rất nhỏ, chứng tỏ quá trình hoàn nguyên vẫn thuận lợi, tuy không triệt để bằng Ca. Để so sánh giá trị ΔG của phản ứng (1) và (2) có thể xem hình 3.
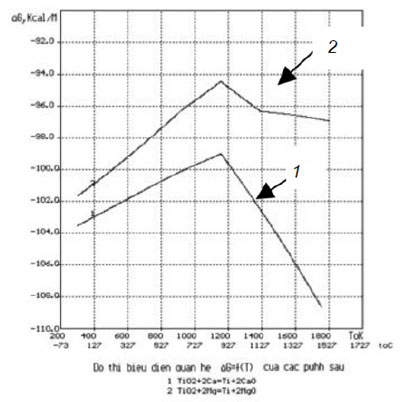
1.3. Đề xuất quy trình hoàn nguyên TiO2 bằng Mg và Ca
Trong quá trình hoàn nguyên, TiO2 luôn tồn tại ở trạng thái rắn. Khi tồn tại độc lập, canxi ở trạng thái rắn cho đến trên 800 oC, magiê ở trạng thái rắn cho đến trên 600 oC. Khi cùng tồn tại, pha lỏng bắt đầu xuất hiện ở nhiệt độ trên 446 oC. Khi nhiệt độ đạt trên 700 oC, Mg và Ca hòa tan hoàn toàn vào nhau ở trạng thái lỏng nên phản ứng lúc đó là phản ứng của TiO2 và bao quanh nó là pha lỏng của chất hoàn nguyên (hình 4).
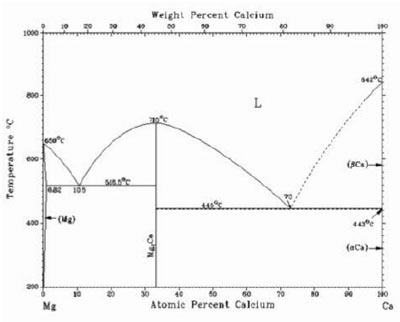
Căn cứ vào kết quả tính toán nhiệt động học và vào trạng thái tồn tại của các pha trong vùng phản ứng, đã đề xuất quy trình hoàn nguyên như sau:
2. Thực nghiệm
Nguyên liệu sử dụng trong thí nghiệm gồm:
– Magiê dạng bột sạch 99 %, kích thước hạt ≤120 μm (Trung Quốc).
– Canxi dạng hạt sạch 99 %, kích thước hạt ≤2,0 mm (Trung Quốc).
– Titan đioxit 99 %, kích thước hạt < 100 μm (Việt Nam).
– Chất trợ dung CaCl2, MgCl2.
Đã tiến hành hai loạt thí nghiệm như sau:
Loạt thứ nhất được thực hiện trong chén phản ứng thép không gỉ 306 dung tích 150 ml (hình 5), được đặt trong bom nhiệt kim dung tích 500 ml (hình 6), có thiết bị đo nhiệt độ và đường nạp khí agon bảo vệ. Các thí nghiệm được thực hiện trên thiết bị nhiệt kim chân không (hình 7) với các điều kiện:
– Nhiệt độ: 650 và 850 oC
– Thời gian: 120 phút

Mỗi thí nghiệm sử dụng 70 g titan đioxit và một lượng (Mg+Ca), hỗn hợp được trộn đều bằng tay, cho vào chén và sấy 30 phút ở nhiệt độ 70 oC. Quá trình hoàn nguyên được tiến hành với tốc độ nâng nhiệt 30 oC/ phút, đến 500 oC, sau đó nâng với 15 oC/ phút cho đến nhiệt độ định trước, giữ ở nhiệt độ đó 20 phút. ở nhiệt độ 300 và 400 oC cũng giữ ở 20 phút để đồng đều nhiệt độ cho toàn bộ lớp bột.
Loạt thí nghiệm thứ hai vẫn được thực hiện trong chén phản ứng thép không gỉ 306 dung tích 150 ml, được đặt trong bom nhiệt kim dung tích 500 ml. Tất cả các thí nghiệm sử dụng khí agon bảo vệ chén phản ứng để tránh oxy hóa. Đợt thí nghiệm này được nghiên cứu ở nhiệt độ cao hơn và thời gian khác nhau:
– Nhiệt độ giữ từ 800 đến 950 oC
– Thời gian giữ nhiệt là 120 phút
– Điểm bắt đầu của quá trình tăng nhiệt độ được xác định cho tất cả các thí nghiệm ở trong lò là 500 oC, gần với nhiệt độ nóng chảy của hợp chất Ca-Mg (516 oC, hình 4), được coi như nhiệt độ bắt đầu phản ứng. Tốc độ nâng nhiệt 30 oC/ phút, nung đến 500 oC, sau đó nung với tốc độ 15 oC/ phút cho đến nhiệt độ định trước, giữ ở nhiệt độ đó 10 phút. ở các nhiệt độ 300 và 400 oC cũng giữ ở 20 phút để đồng đều nhiệt độ cho toàn bộ thể tích lớp bột.
– Để hoàn nguyên triệt để khối lượng TiO2, hỗn hợp Mg-Ca được sử dụng là 120 % so với tính toán lý thuyết. Nếu tăng lượng Mg-Ca tới mức cao hơn 120 %, quá trình hoàn nguyên TiO2 sẽ dư Mg và Ca. Lượng Mg dư một phần bay hơi ngưng tụ phía trên thành chén phản ứng, một phần tích tụ thành Mg hạt bám vào xung quanh thành chén (hình 8d). Lượng Ca dư sẽ tác động đến quá trình làm giảm hiệu suất thu hồi Ti, cụ thể là trong công đoạn tiếp theo khi xử lý sản phẩm hoàn nguyên bằng phương pháp thủy luyện (rửa sản phẩm hoàn nguyên bằng HCl+H2O), canxi dư phản ứng với H2O tạo ra Ca(OH)2 và H2, có ngọn lửa màu vàng cam và có nhiều khí bay lên, có khả năng gây nguy hiểm cho người thao tác. H2 sẽ kết hợp với Ti tạo thành TiH2 gây thất thoát Ti. Vì vậy, dựa vào các kết quả thực nghiệm, đã chọn tỷ lệ chất hoàn nguyên (Mg+Ca)thực tế/(Mg+Ca)lý thuyết = 120 % làm thông số tối ưu cho quá trình nghiên cứu tiếp theo.
– Để đánh giá kết quả nghiên cứu và bước đầu xác định khả năng về những cơ chế phản ứng và để xác định sơ bộ mức độ hoàn nguyên, sau khi hoàn nguyên, sản phẩm được quan sát màu sắc, phân tích hóa học, xác định thành phần. Mẫu cũng được quan sát bằng kính hiển vi điện tử quét (SEM). Ngoài ra sử dụng phương pháp vi phân tích bằng phổ phân tán năng lượng (EDX) để đánh giá mức độ hoàn nguyên.
3. Kết quả và thảo luận
3.1. Sự phân bố sản phẩm hoàn nguyên trong chén hoàn nguyên

Trong tất cả các thí nghiệm, ở trên cùng là lớp dính kết của muối MgCl2 và CaCl2 dùng che phủ khi hoàn nguyên (hình 8c) ngoài ra trên cùng lớp bột sản còn có một lớp magie màu trắng ngưng tụ (hình 8a). Cấu trúc của lớp bột sản phẩm mềm hay rắn phụ thuộc vào quá trình nén nguyên liệu khi cho vào chén để hoàn nguyên (hình 8e, f). Quan sát (hình 8f) nhận thấy ở giữa lớp bột có màu xám sáng là màu của Ti kim loại, ở dưới cùng có màu xám đen, hạt rời là màu của sản phẩm phụ khi hoàn nguyên.
3.2. Cơ chế hoàn nguyên nhiệt Mg-Ca
Trong quá trình hoàn nguyên, khi Mg-Ca đạt đến nhiệt độ nóng chảy, bề mặt lỏng của Mg-Ca (446 oC) tiếp xúc trực tiếp với hạt TiO2, phản ứng sinh nhiệt, tạo ra pha Ti hoàn nguyên trên bề mặt hạt MgO và CaO hoặc là ở dạng các hạt nhỏ rời, hoặc là ở trong vùng hoàn nguyên của các pha Mg, Ca, Ti, TiO và Ti2O3. Nhiệt sinh ra duy trì Mg-Ca kim loại lỏng. Pha lỏng Mg-Ca tiếp tục phản ứng với TiO2. Đó là phản ứng dây chuyền. Hơn thế nữa nhiệt sinh ra làm tăng nhiệt độ chung lên rất nhanh cho đến nhiệt độ bay hơi của Mg, và Mg bốc hơi, xen qua kẽ của các hạt TiO2 và đọng lại trên lớp bột.
Thời điểm bắt đầu của phản ứng có thể coi như phản ứng lỏng-rắn. Những hạt đầu tiên tiếp xúc với pha lỏng Mg-Ca chỉ cho mức độ hoàn nguyên thấp, nằm ở dưới đáy nồi và là các hạt rời như đã quan sát thấy. Tiếp theo là giai đoạn hoàn nguyên từ pha TiO2 sang các pha oxit trung gian theo lượng oxy giảm dần. Giai đoạn này xảy ra nhanh. Tuy nhiên quá trình từ các oxit trung gian sang Ti kim loại lại chậm do phải thực hiện sự chuyển đổi cấu trúc tinh thể từ các pha oxit sang cấu trúc của Ti kim loại. Quá trình đó xảy ra ở giữa nồi.
3.3. Ảnh hưởng của nhiệt độ hoàn nguyên
Trong cả hai loạt thí nghiệm, thành phần hợp kim được phân tích tương ứng với khoảng nhiệt độ hoàn nguyên từ 650 đến 950 oC. ở nhiệt độ 500 oC tuy quá trình hoàn nguyên đã bắt đầu xảy ra nhưng đó là quá trình hoàn nguyên mức độ thấp, sản phẩm chủ yếu là các oxit trung gian ở dạng Ti2O3, Ti2O, TiO. Khi nhiệt độ đạt trên 700 oC, với thời gian là 120 phút, quá trình hoàn nguyên bắt đầu đạt được hiệu suất cao. Trong khoảng nhiệt độ tối thiểu là 700 oC và tối đa là 850 oC kết quả hoàn nguyên đạt được mức cao nhất (thí nghiệm 4, bảng 3). Khi tăng nhiệt độ hoàn nguyên lên trên 850 oC, hiệu suất thu hồi giảm. Nguyên nhân là do ở nhiệt độ cao một phần titan kim loại sinh ra đã hợp kim hóa với canxi thành các liên kim là chất rất dễ hoà tan trong quá trình xử lý sản phẩm hoàn nguyên bằng dung môi (HCl+H2O).
Mẫu phân tích bằng SEM-EDX cho thấy hình ảnh các hạt Ti và thành phần tại các điểm phân tích đạt trên 97 % (hình 9).
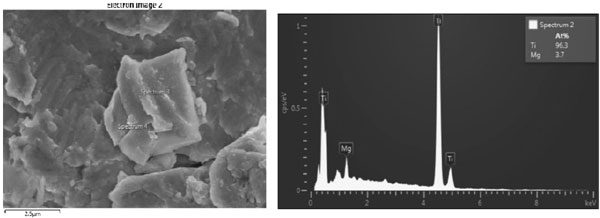
4. Kết luận
Kết quả tính toán nhiệt động học quá trình hoàn nguyên nhiệt magiê và nhiệt canxi cho thấy giá trị ΔG của phản ứng hoàn nguyên TiO2 bằng Mg và Ca đều có giá trị khá âm, nghĩa là cả hai nguyên tố đều có khả năng hoàn nguyên TiO2 cho Ti kim loại. Khả năng hoàn nguyên của Ca tốt hơn so với Mg. Theo giản đồ trạng thái, tại nhiệt độ trên 446 oC, hỗn hợp hai nguyên tố này đã có khả năng tồn tại pha lỏng.
Các thí nghiệm hoàn nguyên TiO2 bằng phương pháp nhiệt hỗn hợp Mg+Ca, thực hiện với thời gian hoàn nguyên là 2 giờ, tỷ lệ chất hoàn nguyên (Mg+Ca)thực tế/(Mg+Ca) lý thuyết = 120 %, có sự xuất hiện sớm của pha lỏng, đã thu được sản phẩm hỗn hợp với lượng Ti đạt 94 %.
Hiệu suất hoàn nguyên đạt được mức cao nhất khi nhiệt độ là 850 oC. Sử dụng chất hoàn nguyên là hỗn hợp Mg và Ca sẽ tiết kiệm chi phí rất nhiều so với sử dụng 100 % Ca làm chất hoàn nguyên.
TÀI LIỆU TRÍCH DẪN
- Hội KHKT Đúc-luyện kim Việt Nam, Báo cáo hội thảo khoa học “Tư vấn phát triển công nghiệp titan Việt Nam”, Hà Nội, 3/2011
- Phạm Phố, Mạc úy, Phạm Huy Bình và Võ Thế Sơn, Titan – Vật liệu tương lai, NXB Đại học Công nghiệp, Tp Hồ Chí Minh, 2011
- H. Zheng, H. Ito, T. H. Okabe, Production of titanium powder by the calciothermic reduction of titanium con- centrates ore using the preform reduction process, Materials Transactions, 48, 2007, pp 2244 – 2251
- Nguyễn Kim Thiết, Chương trình tính nhiệt động học, trường Đại học Bách khoa Hà Nội, 2000, https://drive.google.com/?tab=mo&authuser=0#recent

