Trong nghiên cứu này đã sử dụng nghiền năng lượng cao để tổng hợp cacbit crom (Cr3C2) từ trioxit crom (Cr2O3) và muội than (C)…
The mechanism of carbothermal reduction process of high-energy mechanical milling mixture of Cr2O3 and C
Vũ Huy Thăng1, Trần Quốc Lập2
1Bộ Giáo dục và Đào tạo, Email: thangkhh@gmail.com
2Trường Đại học Bách khoa Hà Nội
Ngày nhận bài: 24/2/2015, Ngày duyệt đăng: 2/4/2015
TÓM TẮT
Trong nghiên cứu này đã sử dụng nghiền năng lượng cao để tổng hợp cacbit crom (Cr3C2) từ trioxit crom (Cr2O3) và muội than (C). Kết quả phân tích nhiễu xạ rơnghen, phân tích nhiệt vi sai (DTA) và khối lượng (TG) của những mẫu nghiền với thời gian khác nhau cho thấy nghiền năng lượng cao đã thúc đẩy quá trình khuếch tán của các nguyên tử cacbon trong các trioxit crom. Hơn nữa, nhiệt độ tổng hợp cacbit crom đã giảm xuống 80 oC đối với mẫu nghiền sau 18 giờ và 100 oC ở mẫu nghiền 30 giờ.
Từ khóa: Nghiền năng lượng cao, oxit crom, DTA, cacbit crom, tổng hợp Cr3C2
ABSTRACT
The high-energy mechanical milling for synthesis of Cr3C2 from Cr2O3 and C powders was realized in this work. The analyzing of X-ray diffraction patterns and DTA, TG curves of samples, milled for different times, showed that the high-energy mechanical milling process gave an impulse to the difusion of carbon atom in lattice of chromium (III) oxit. Furthermore, in the same sintering process, the formative temperature of Cr3C2 reduces 80 oC by 18 h milling time and 100 oC by 30 h milling time.
Keywords: High-energy milling, chromium oxide, DTA, chromium carbide, synthesis of Cr3C2
1. Đặt vấn đề
Cacbit của các kim loại chuyển tiếp có nhiệt độ nóng chảy, độ cứng và tính chịu nhiệt rất cao. Những vật liệu này có tính dẫn điện, dẫn nhiệt tốt. Các thuộc tính này cho phép chúng được sử dụng rộng rãi trong nhiều lĩnh vực. Ngoài ra, cacbit crom (Cr3C2) còn là một hợp chất có khả năng chống mài mòn cao, tính chống gỉ tốt nên trong các ngành công nghiệp có nhu cầu rất lớn.
Trong công nghiệp, cacbit crom được tổng hợp từ oxit crom và cacbon. Tuy nhiên để tổng hợp Cr3C2 cần nhiệt độ cao (> 1400 oC), thời gian dài (> 4 giờ), công nghệ và thiết bị phức tạp nên giá thành cacbit cao [1]. Nhằm giảm giá thành của cacbit crom đòi hỏi phương pháp tổng hợp sử dụng nhiệt lượng thấp hơn và thời gian ngắn hơn. Nhìn chung, để cải tiến phương pháp tổng hợp vật liệu cần thiết sự hiểu biết chi tiết cơ chế quá trình.
Phản ứng tổng hợp cacbit crom trong trạng thái rắn từ oxit crom và cacbon có thể viết dưới dạng sau:
Oxit (r) + Cacbon (r) → Cacbit (r) + CO (k) (1)
Sản phẩm của phản ứng gồm pha cacbit rắn và chất khí, như vậy hoặc là hạt oxit hoặc là hạt cacbon sẽ là tiền chất của hạt cacbit tạo thành. Hạt chất nào là tiền chất của cacbit crom phụ thuộc vào cơ chế chuyển chất trong phản ứng và độ linh hoạt của các chất [2].
Nghiên cứu về cơ chế phản ứng khử oxit crom bằng cacbon, Katayama H.G. [3] đã đề xuất cơ chế vận chuyển chất là quá trình khuếch tán của cặp khí CO/CO2 qua lớp sản phẩm cacbit. Cơ chế vận chuyển chất của cặp khí CO/CO2 cũng được Weimer A.W. [4] đề xuất trong phản ứng nhiệt cacbon để tổng hợp SiC và sau đó được Berger L.M. [5] đề xuất trong phản ứng nhiệt cacbon để tổng hợp TiC. Theo đó, đầu tiên CO được sinh ra trên bề mặt tiếp xúc giữa hạt cacbon và hạt Cr2O3. Khí CO được sinh ra tiếp tục phản ứng với Cr2O3 tạo ra CO2. Khí CO2 được vận chuyển đến bề mặt hạt C và phản ứng với C để tái sinh CO. Quá trình vận chuyển của cặp khí này đi qua lớp sản phẩm cacbit tạo thành. Qua phân tích thành phần pha khí, các nghiên cứu đều cho rằng đây là cơ chế vận chuyển chất trong các phản ứng tổng hợp cacbit kim loại chuyển tiếp từ các oxit của chúng và cacbon [2].
Các nghiên cứu đều cho rằng, hợp chất Cr3C2 được sinh ra đầu tiên sau đó là Cr7C3. Hợp chất Cr23C6 chỉ được tạo ra trong điều kiện nhiệt độ và hàm lượng C hợp lý. Do hợp chất Cr3C2 có hàm lượng cacbon lớn nhất trong các cacbit crom, Katayama H.G [3] cho rằng hạt C là tiền chất của Cr3C2 và lớp Cr3C2 tạo thành bao quanh hạt C. Tuy nhiên, bằng tính toán nhiệt động học quá trình và kết quả thực nghiệm, các nghiên cứu sau này khẳng định rằng Cr2O3 là tiền chất của Cr3C2. Trong nghiên cứu về quá trình nhiệt cacbon của oxit crom, Berger L.M. [2] cũng đưa ra các kết quả thực nghiệm để khẳng định tiền chất của Cr3C2 là Cr2O3 và cacbit Cr3C2 được sinh ra đầu tiên. Trong nghiên cứu về thành phần pha khí của phản ứng này, Gordienko S.P. [6] đã đề xuất, cacbit Cr3C2 được tạo ra đầu tiên trên bề mặt hạt oxit và sau đó cacbit Cr7C3 là sản phẩm của phản ứng giữa Cr2O3 và Cr3C2.
Khi phân tích nhiệt vi sai hỗn hợp bột Cr2O3 và muội than có kích thước nano, giống như kết quả của Popov A.A. [7], Zhiwei Zhao [8] thấy xuất hiện pic tỏa nhiệt ở khoảng nhiệt độ 600 đến 900 oC và cho rằng pic này là kết quả của phản ứng:
Cr2O3 + C = 2CrO + CO ↑ (2)
Trong nghiên cứu về nhiệt động học quá trình, Popov A.A. [7] cho rằng phản ứng tạo Cr3C2 xảy ra ở nhiệt độ khoảng 1100 đến 1270 oC. ở khoảng nhiệt độ từ 1270 đến 1480 oC, cacbit Cr7C3 được sinh ra trong phản ứng giữa Cr2O3 và Cr3C2. Phản ứng tạo ra Cr23C6 trong khoảng nhiệt độ từ 1480 đến 1660 oC. Zhiwei Zhao [1] và Berger L.M. [5] đã nhận được Cr3C2 từ Cr2O3 và muội than ở nhiệt độ 1100 oC.
Nghiên cứu ảnh hưởng của hàm lượng C trong hỗn hợp bột ban đầu đến thành phần sản phẩm phản ứng, Berger L.M. [5] đã nung hỗn hợp bột Cr2O3 với cùng loại graphit nhưng hàm lượng khác nhau đến 1400 oC và nhận thấy rằng: với hỗn hợp có hàm lượng C thấp nhận được sản phẩm là Cr2O3 và Cr23C6; với hàm lượng C trung bình thì cho sản phẩm gồm Cr2O3, Cr7C3 và Cr23C6; với hàm lượng C dư thì cho sản phẩm Cr2O3, Cr7C3, Cr3C2 và C dư.
Nhằm đưa ra phương pháp giảm thiểu chi phí để tổng hợp cacbit crom, mục đích của bài báo này trình bày ảnh hưởng của cơ năng do nghiền năng lượng cao gây ra đến cơ chế tổng hợp cacbit crom từ oxit crom và muội than.
2. Thực nghiệm
Bột Cr2O3 được sử dụng có kích thước khoảng 200 μm và độ sạch trên 99%. Cacbon được sử dụng là muội than có kích thước khoảng 200 μm. Tỷ lệ thành phần về khối lượng hỗn hợp bột được tính theo phản ứng:
3Cr2O3 + 13C = 2Cr3C2 + 9CO (3)
Hỗn hợp bột được trộn đều và nghiền trong máy nghiền hành tinh Pulverisette 5. Tốc độ nghiền là 350 vòng/phút, tỷ lệ về khối lượng bi:bột là 20:1. Các mẫu cùng được nghiền với thời gian là: 6, 12, 18, 24 và 30 giờ.
Các mẫu được thiêu kết trong môi trường khí Ar bằng thiết bị phân tích nhiệt vi sai Labsys Evo. Quá trình thiêu kết bắt đầu từ nhiệt độ phòng đến 1300 oC với tốc độ gia nhiệt 10 oC/phút.
Các mẫu sau phân tích nhiệt được khảo sát trên máy nhiễu xạ rơnghen D8-Advance, với chế độ là 40 kV; 40 mA, bức xạ CuKα có bước sóng λ = 1,5406.
3. Kết quả và thảo luận
Quá trình nghiền năng lượng cao là quá trình lặp đi lặp lại sự hàn nguội và đập vỡ các hạt bột vật liệu. Như vậy, sản phẩm của nghiền là những hạt bột có kích thước nhỏ mịn và chứa nhiều khuyết tật mạng [9]. Khuếch tán là cơ chế chủ yếu ở các phản ứng trong trạng thái rắn. Sự hàn nguội giữa các hạt bột khác chất làm cho quá trình khuếch tán lẫn nhau tại bề mặt tiếp xúc giữa các hạt dễ dàng hơn và có thể xảy ra ở nhiệt độ thấp. Sự nhỏ mịn của các hạt bột làm giảm khoảng cách khuếch tán trong mạng tinh thể làm phản ứng xảy ra nhanh hơn. Ngoài ra, sự tăng lên của bề mặt tự do và khuyết tật mạng làm tăng nội năng của hạt bột. Như vậy, hỗn hợp bột nhận được năng lượng dự trữ do nghiền năng lượng cao mang lại. Năng lượng hoạt hóa khuếch tán (ΔE) trong mạng tinh thể bao gồm năng lượng tạo nút trống (ΔEt) và năng lượng để dịch chuyển nguyên tử (ΔEd) vào nút trống. Va chạm trong nghiền năng lượng cao tạo ra lượng lớn các khuyết tật mạng tinh thể (các lệch và nút trống). Qua đó, năng lượng tạo nút trống đã được giảm, do chúng được sinh ra đáng kể trong quá trình nghiền, dẫn đến năng lượng hoạt hóa khuếch tán giảm xuống. Hệ số khuếch tán có thể được viết theo công thức Arrhenius:
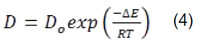
Từ đây dễ dàng nhận thấy, tại một nhiệt độ, sự giảm xuống của năng lượng hoạt hóa khuếch tán tương đương với khả năng khuếch tán tăng lên.
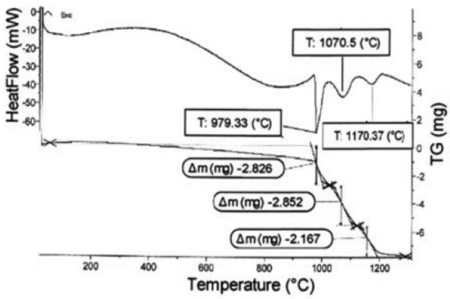
Ảnh hưởng của nghiền năng lượng cao tới quá trình tổng hợp cacbit crom từ Cr2O3 và C được phân tích trên các đường cong phân tích nhiệt vi sai (DTA) và phân tích khối lượng (TG) của các mẫu với thời gian nghiền khác nhau. Hình 1, 2, 3 tương ứng là các đường cong DTA và TG của các mẫu sau 6, 12, 24 giờ nghiền năng lượng cao.
Trên các đường DTA và TG của cả 3 mẫu nghiền không có sự biến đổi trong khoảng nhiệt độ 200 đến 950 oC điều đó cho thấy không xảy ra phản ứng (2) nêu trên.
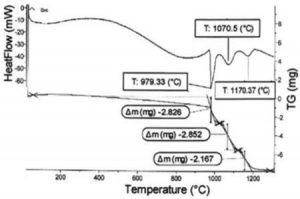
Trên đường cong DTA của mẫu sau 6 giờ nghiền (hình 1), rõ ràng có 3 pic thu nhiệt tương ứng ở nhiệt độ 979, 1070 và 1170 oC. Theo đề xuất của Popov A.A. [7], đây chính là 3 pic của 3 phản ứng tương ứng tạo Cr3C2, Cr7C3 và Cr23C6. Nhiệt độ của các phản ứng này đã giảm xuống do nghiền năng lượng cao làm giảm năng lượng hoạt hóa khuếch tán của quá trình.
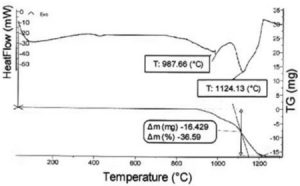
Đường cong phân tích nhiệt của mẫu sau 12 giờ nghiền (hình 2), cho thấy chỉ còn 2 pic thu nhiệt tương ứng ở nhiệt độ 987 và 1124 oC. Độ lớn của pic tại nhiệt độ 1124 oC cho thấy, khả năng khuếch tán của các nguyên tử C trong mạng tinh thể oxit crom tăng lên làm cho phản ứng tạo Cr23C6 xảy ra đồng thời với phản ứng tạo Cr7C3. Pic tại nhiệt độ 987 oC tương ứng với phản ứng tạo Cr3C2 rất yếu, có lẽ do trong thời gian xảy ra phản ứng tạo Cr3C2 thì các nguyên tử C đồng thời đã khuếch tán vào sâu hơn trong mạng tinh thể. Như vậy, phản ứng tạo cacbit crom đã hoàn thành ở nhiệt độ thấp hơn (1124 oC). Điều này chứng tỏ khi thời gian nghiền tăng lên, khuyết tật mạng tinh thể tăng dẫn đến khả năng khuếch tán của nguyên tử C trong mạng tăng.
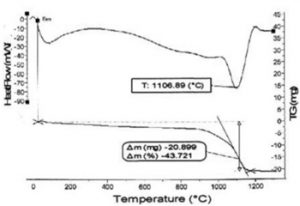
Thời gian nghiền tiếp tục tăng, khuyết tật mạng tăng dẫn đến khả năng khuếch tán đồng đều của các nguyên tử C trong mạng tinh thể. Đường cong DTA của mẫu 24 giờ nghiền (hình 3) chỉ còn một pic là của phản ứng từ oxit crom tạo thành cacbit và nhiệt độ tạo cacbit đã giảm xuống còn 1106 oC.
Quá trình tổng hợp cacbit crom xảy ra theo từng bước, các dạng cacbit với hàm lượng C khác nhau được tạo ra ở nhiệt độ khác nhau. Cacbit có hàm lượng C cao được tạo ra đầu tiên ở nhiệt độ thấp, khi nhiệt độ tăng dần sẽ tạo ra cacbit crom với hàm lượng C thấp dần. Điều đó chứng tỏ, sự khuếch tán của nguyên tử C càng vào sâu trong mạng càng đòi hỏi năng lượng hoạt hóa cao hơn. Nghiền năng lượng cao với thời gian dài đưa đến năng lượng hoạt hóa khuếch tán của các nguyên tử C ở mọi vị trí trong mạng tinh thể oxit crom là như nhau và thấp hơn. Nhiệt độ tổng hợp cacbit crom phụ thuộc vào thời gian nghiền được thể hiện ở bảng 1 và hình 4.
Bảng 1. Phụ thuộc của nhiệt độ tổng hợp cacbit crom (T) vào thời gian nghiền (ô)
| τ (giờ) | 0 | 6 | 12 | 18 | 24 | 30 |
| T (oC) | 1200 | 1170 | 1124 | 1114 | 1106 | 1101 |
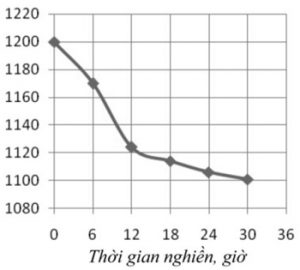
Từ hình vẽ cho thấy thời gian nghiền càng tăng thì nhiệt độ tổng hợp cacbit crom càng giảm. Xét hiệu quả tổng hợp cacbit crom cho thấy, sau 15 giờ nghiền, nhiệt độ tổng hợp cacbit chỉ còn khoảng 1120 oC. Tuy nhiên, nhiệt độ tổng hợp giảm không nhiều khi thời gian nghiền tăng lên (nghiền đến 30 giờ, nhiệt độ chỉ giảm xuống thêm khoảng 20 oC). Như vậy, để quá trình tổng hợp Cr3C2 từ Cr2O3 và muội than có sử dụng nghiền năng lượng cao đạt hiệu quả cao nhất thì nghiền hỗn hợp bột khoảng 15 giờ.
cao ảnh hưởng mạnh mẽ đến quá trình thiêu kết tổng hợp cacbit crom. Đó là do trong giai đoạn này, quá trình giảm kích thước hạt và mất trật tự mạng tinh thể hạt bột xảy ra mạnh mẽ. Sau 15 giờ nghiền có thể các hạt bột đã đạt tới giới hạn nhỏ mịn và bị biến cứng, tốc độ hàn nguội và đập vỡ các hạt bột trở nên cân bằng. Khi cấu trúc các hạt bột tiến tới trạng thái vô định hình thì việc nghiền năng lượng cao không còn ảnh hưởng mạnh tới quá trình thiêu kết tổng hợp cacbit crom.
Từ các đường TG của các mẫu thiêu kết dễ dàng nhận thấy, trong khoảng nhiệt độ từ nhiệt độ phòng tới 900 oC không thấy sự biến đổi về khối lượng (hình 2), chứng tỏ hợp chất Cr2O3 là hợp chất bền vững và trong quá trình tổng hợp cacbit crom không xảy ra phản ứng khử oxy để tạo oxit crom với hàm lượng oxy thấp hơn (phản ứng (2) không xảy ra trong quá trình thực nghiệm ở đây). Phù hợp với đề xuất của nhiều tác giả, hợp chất Cr2O3 là tiền chất của cacbit crom.

Hình 5 là giản đồ nhiễu xạ rơnghen của mẫu sau 12 giờ nghiền đã được nung đến 1250 oC. Từ giản đồ có thể thấy không còn pic của oxit crom hay pic của crom, chứng tỏ phản ứng tổng hợp cacbit crom đã hoàn tất vì từ các đường cong phân tích nhiệt vi sai cho thấy từ khoảng nhiệt độ 1200 oC đến 1300 oC trong hỗn hợp bột không còn chuyển biến nào.
4. Kết luận
Cacbit crom đã nhận được sau thiêu kết đến 1200 oC cho các mẫu nghiền năng lượng cao hỗn hợp bột C và Cr2O3. Nghiền năng lượng cao đã ảnh hưởng tới nhiệt độ tổng hợp cacbit crom, thời gian nghiền càng tăng thì nhiệt độ tổng hợp cacbit crom càng giảm. So với mẫu không nghiền, nhiệt độ phản ứng tạo cacbit crom giảm 80 oC đối với mẫu nghiền sau 18 giờ và 100 oC ở mẫu nghiền 30 giờ.
Độ mất trật tự mạng tinh thể tiền chất của cacbit Cr2O3 tăng theo thời gian nghiền và thúc đẩy mạnh quá trình khuếch tán của các nguyên tử C trong mạng tinh thể Cr2O3.
TÀI LIỆU TRÍCH DẪN
- Zhiwei Zhao, Hongjuan Zheng, Yanrong Wang, Shufang Mao, Jinping Niu, Yan Chen và Mengying Shang; Synthesis of chromium carbide (Cr3C2) nanopowders by the carbonization of the precursor; Int. Journal of refractory metals and hard materials, 29, 2011, p.614-617
- Berger L.M., Stolle S., Griner W. và Wetzig K.; Investigation of the carbothermal reduction process of chromi- um oxide by micro- and lab-scale methods; International journal of refractory metals and hard materials, 19, 2001, p.109-121
- Katayama H. G.; Mechanism of the reduction of chromic oxide by cacbon; Nippon kinzoku gakkaishi, 40, 1976, p.993-999
- Weimer A.W., Nilsen K. J., Cochran G. A. và Roach R. P.; Kenetics of carbothermal reduction synthesis of beta silicon carbide; AIChE juornal, 39, 1993, p.493-503
- Berger L.M., Gruner W., Langholf E. và Stolle S.; On the mechanism of carbothermal reduction processes of TiO2 and ZrO2, International Journal of Refractory Metals and Hard Materials, 17, 1999, p.235-243
- Gordienko S. P., Klochkov L. A. và Kritsky V. V.; Composition of the gaseous phase during the carbothermic preparation of chromium and molybdenum carbides in vacuum; Porosh metall, 11, 1986, p.45-49
- Popov A. A., Ostrik P. N. và Gasik M. M.; Thermodynamics of reduction and carbide formation in the Cr-C- O system; Izv vysh. uchebn. zaved. chern. metall., 29,1986, p.1-3
- Zhiwei Zhao, Hongjuan Zheng, Shujun Zhang, Weiqiang Song, Shufang Mao, Yan Chen; Effect of reaction time on phase composition and microstructure of chromium carbide nanopowders; Int. Journal of refractory metals and hard materials, 41, 2013 p.558-562
- Suryanarayana C.; Mechanical alloying and milling; Progress in materials science, 46, 2001, p.1-184.