Bài báo này trình bày quá trình nghiên cứu xây dựng giản đồ E-pH hệ 5 nguyên Bi-S-Cl-H2O, nhằm xác định miền tồn tại của bismut trong dung dịch có chứa ion clo và ion lưu huỳnh ở các điều kiện pH khác nhau…
Building of E-pH diagram of Bi-S-Cl-H2O for the bismuth sulfide concentrate leaching study
TRẦN TRUNG TỚI, NGUYỄN KIM THIẾT, ĐINH TIẾN THỊNH, ĐINH PHẠM THÁI
Trường Đại học Bách khoa Hà Nội
Ngày nhận bài: 26/10/2015, Ngày duyệt đăng: 28/11/2015
TÓM TẮT
Bài báo này trình bày quá trình nghiên cứu xây dựng giản đồ E-pH hệ 5 nguyên Bi-S-Cl-H2O, nhằm xác định miền tồn tại của bismut trong dung dịch có chứa ion clo và ion lưu huỳnh ở các điều kiện pH khác nhau. Từ đó làm cơ sở cho nghiên cứu thực nghiệm hòa tách tinh quặng bismut sunfua trong dung môi HCl.
Từ khoá: bismut sunfua, giản đồ E – pH, bismut.
ABSTRACT
The main purpose of this study is to build E-pH diagrams of the system Bi-S-Cl-H2O at ambient temperature in order to determine the existence of bismuth in a solution that contains chloride ions and sulfur ions at different pH conditions. This can be used as a basis for leaching studies of bismuth sulfide concentrate in solution of acid HCl
Keywords: bismuth sulfide, diagram E – pH, bismuth.
1. ĐẶT VẤN ĐỀ
Ở nước ta, những năm gần đây, đã phát hiện ra những mỏ có trữ lượng rất lớn, điển hình là mỏ Núi Pháo [1], trữ lượng huỳnh thạch, vonfram, bismut đạt tầm cỡ trên thế giới. Đặc biệt trữ lượng kim loại Bi vượt xa các nước (trừ Trung Quốc). Nghiên cứu này đề cập đến vấn đề xử lý tinh quặng bismut chứa khoáng Bi2S3. Khi hòa tan trong môi trường HCl, ngoài H2O ra hệ còn có các cấu tử Bi, S, Cl. Muốn biết Bi tan ra dưới dạng ion nào, ảnh hưởng pH và chất oxy hóa ra sao, các tác giả đã nghiên cứu lập giản đồ E-pH hệ 5 nguyên Bi-S-Cl-O-H hoặc Bi-S-Cl-H2O.
2. PHƯƠNG PHÁP XÁC LẬP GIẢN ĐỒ E-PH
Từ công thức Nernst
EMe = EoMe + [RT/zF].ln[CMez+/CMe]
ta thấy thế điện cực của kim loại chỉ thể hiện được quan hệ φ = f(Ci), mà không thể hiện được ảnh hưởng của pH. Quá trình điện cực xảy ra trong dung dịch nước nên giá trị pH có ý nghĩa rất quan trọng. Thực ra pH có ảnh hưởng rất lớn đến quá trình điều chỉnh cân bằng của điện cực. Giản đồ cân bằng E-pH do Pourbaix [2] xác lập (nên thường gọi là giản đồ Pourbaix) có thể mô tả được mối quan hệ E của một kim loại với nồng độ ion của nó và pH. Tất cả các quá trình hoá học và điện hoá được thể hiện qua các miền ưu tiên tồn tại và xu hướng dịch chuyển cân bằng của mỗi cấu tử trong hệ, tuỳ thuộc vào E, pH, Ci (hoạt độ) hoặc Pi (áp suất). Đường biểu diễn quan hệ E-pH của mỗi phản ứng hóa học gọi là đường giới hạn của các chất của 2 vế của phản ứng hóa học. Ghép nhiều đường giới hạn của một chất ta có một miền tồn tại của chất đó.
Để xác lập giản đồ Pourbaix cho một hệ nào đó, cần tiến hành theo các bước sau đây:
– Đầu tiên phải liệt kê tất cả các chất có trong hệ định nghiên cứu, thu thập tất cả các số liệu của chúng: trạng thái vật chất, công thức hoá học, đặc biệt là các số liệu nhiệt động học ΔG0 hoặc Δμ0.
Với những chất tuy đã phát hiện nhưng chưa có các số liệu nhiệt động học thì cũng không thể tìm được miền tồn tại của chúng.
– Tính toán quan hệ E-pH của tất cả các phản ứng hoá học có sự tham gia của H+ ứng điện hoá có thể xẩy ra.
Cách xác lập giản đồ E-pH được tiến hành theo phương pháp của Pourbaix. Sử dụng phần mềm “Nhiệt động học” [3] để vẽ các đường của giản đồ và tìm miền ưu tiên tồn tại của các chất trong hệ.
Để số hóa các ion của phương trình hóa học, quy ước cho máy tính hiểu được như sau (kết quả máy tính in ra cũng theo quy ước này).
Ion âm: ví dụ BiCl– viết là BiCl ’
Ion dương: ví dụ H+ viết là H`
Các đường đều ghi số thứ tự tương ứng với các phản ứng hóa học là đường giới hạn các miền ưu tiên tồn tại của các chất tham gia và hình thành trong phản ứng đó.
3. XÂY DỰNG GIẢN ĐỒ HỆ 5 NGUYÊN
Giản đồ hệ Bi-S-Cl-H2O được xây dựng trên cơ sở ghép hệ 4 nguyên Bi-Cl-H2O được lấy từ tài liệu [4] và hệ 3 nguyên S-H2O được xây dựng lại từ dữ liệu giản đồ Pourbaix [2] trên phần mềm máy tính của chương trình nhiệt động học [3]. Khi vẽ lồng ghép 2 giản đồ này ta được giản đồ E-pH như hình 1. Đường liền và chữ đậm là hệ Bi-Cl-H2O, còn đường chấm chấm và chữ gầy là hệ S-H2O.
Trong hệ 5 nguyên Bi-S-Cl-H2O, ngoài các chất đã có trong hệ 4 nguyên Bi-Cl-H2O là Bi, BiCl4–, BiOCl…(hình 1) và 3 nguyên S-H2O là HSO4–, SO42-, S2-, HS– còn có một chất mới xuất hiện là Bi2S3 với dữ liệu nhiệt động học như sau:
| Chất mới | Trạng thái | ΔG0298 (cal/mol) | Tài liệu tham khảo |
| Bi2S3 | Rắn | -39 400 | [5] |
Mỗi chất (dạng ion, phân tử, nguyên tử) trong hai hệ đều tồn tại trong các miền giá trị E và pH nhất định. Những chất tồn tại trong miền đó thì sẽ có thể tương tác với nhau tạo thành chất mới, ví dụ như Bi2S3. Do đó cần xác định miền ưu tiên tồn tại của chất mới Bi2S3 này. Đây là công việc rất khó khăn và phức tạp vì phải tổ hợp tất cả các khả năng tương tác của các chất và khảo sát trên giản đồ, sau đó loại trừ các phản ứng không cần thiết.
Theo kinh nghiệm, sunfua kim loại sẽ tồn tại cùng một miền với S nguyên tố. Do đó sẽ tập trung vào khảo sát các vùng xung quanh miền tồn tại của lưu huỳnh S. Những vùng có cùng loại ion và các chất, cần khoanh lại thành một miền. Theo cách như vậy có 7 miền như trên hình 1.
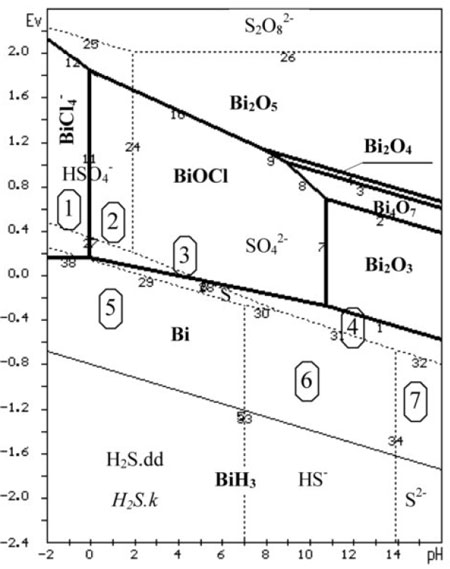
Sau đây ta xét cụ thể từng miền và các phản ứng tương tác xảy ra với Bi2S3 (ở đây, số thứ tự của phản ứng đánh tiếp theo số thứ tự của các phản ứng của hệ Bi-Cl-H2O):
* Miền 1: ion BiCl4, HSO4
13. Bi2S3 + 8Cl– + 12H2O = 3HSO4– + 2BiCl4– + 21H+ + 24e
E = 0.365 – 0.052pH + 0.0025lgC
* Miền 2: ion HSO4–, rắn BiOCl
14. Bi2S3 + 2Cl– +14H2O = 3HSO4–+2BiOCl + 25H+ + 24e
E = 0.365 – 0.062pH + 0.0025lgC
* Miền 3: ion SO42-, rắn BiOCl
15. Bi2S3 + 2Cl– +14H2O = 3SO42- + 2BiOCl + 28H+ + 24e
E = 0.379 – 0.069pH + 0.0025lgC
* Miền 4: ion SO42-, rắn Bi
16. Bi2S3+12H2O = 3SO42- + 2Bi + 24H+ + 18e
E = 0.339 – 0.059pH + 0.0025lgC
* Miền 5: dung dịch hòa tan H2S, Bi
17. 3H2S + 2Bi = Bi2S3 + 6H+ + 6e
E = -0.143 – 0.059pH + 0.0098lgC
* Miền 6: HS–, Bi
18. 3HS– + 2Bi = Bi2S3 + 3H+ + 6e
E = -0.350 – 0.030pH + 0.0098lgC
* Miền 7: S2-, Bi
19. 3S2- + 2Bi = Bi2S3 + 6e
E = -0.761 + 0.0098lgC
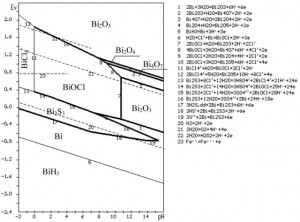
Từ các phản ứng hóa học này, nhờ phần mềm máy tính vẽ được các miền tồn tại của các chất trong hệ 5 nguyên như hình 2 và hình 3. Trong hình 3 còn thêm đường 21, 22 và 23, là giới hạn miền tồn tại của oxy, H2O2 với nước và cặp Fe2+/Fe3+ để tiện so sánh khả năng oxy hóa của chúng.
Nhận xét:
– Điểm khác biệt cơ bản về vùng tồn tại của bis- mut trong giản đồ trạng thái hệ 5 nguyên Bi-S-Cl- H2O là có thêm vùng tồn tại của pha rắn Bi2S3 với diện tích chiếm chỗ phần lớn miền tồn tại của Bi và một phần lẫn vào miền tồn tại của BiOCl và BiCl4– trong giản đồ trạng thái E-pH hệ 4 nguyên Bi-Cl- H2O, và bao phủ hết vùng tồn tại của S trong giản đồ 3 nguyên S-H2O, giới hạn bởi các đường 13, 14, 15, 16, 17, 18, 19 (hình 2).
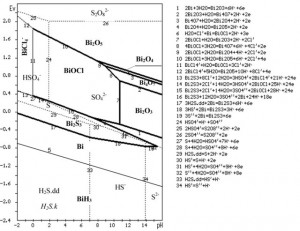
– Trong môi trường có chứa ion clo, tùy theo độ lớn của pH và E, khi Bi2S3 tan ra, bismut chỉ có thể tồn tại dưới dạng ion BiCl4– và các dạng pha rắn BiOCl, Bi, Bi2O3, BiH3 và Bi2O5 (trong môi trường oxy hóa), Bi, BiH3 (trong môi trường hoàn nguyên).
Lưu huỳnh và các ion của nó không có tương tác gì với clo, vẫn tồn tại như trong hệ S-H2O, tức là HSO4–, SO2-, S2O2- (trong môi trường oxy hóa) và tan trong nước H2Sdd, thể khí H2Sk và ion HS–, S2- (trong môi trường hoàn nguyên – xem hình 2).
Trước đó Habashi [6] vẫn cho rằng hòa tách tinh quặng có chứa khoáng Bi2S3 sẽ tạo ra BiCl3 và H2S theo phản ứng
Bi2S3 + 6HC1 → 2BiCl3 + 3H2S
Điều này là không có cơ sở.
– Về ảnh hưởng của chất oxy hóa, nồng độ axit và clo, ta hãy xét phản ứng số 13, là phản ứng chính hòa tan Bi2S3
13. Bi2S3+ 8Cl– + 12H2O = 2BiCl4– + 3HSO4–+ 21H+ + 24e
+ Ảnh hưởng của chất oxy hóa: Phản ứng tạo ra BiCl4- đồng thời giải phóng các electron (e) cho nên đây là phản ứng theo chiều oxy hóa. Muốn thúc đẩy quá trình cần cho thêm các chất oxy hóa.
Đường cân bằng của oxy và H2O2 với nước ở phía trên đường 13 rất nhiều, chứng tỏ tác dụng oxy hóa của chúng rất mạnh. So với oxy, H2O2 là tác nhân oxy hóa mạnh hơn oxy nhiều nếu chúng có cùng hoạt độ.
+ Ảnh hưởng của nồng độ axit: Phản ứng tạo ra BiCl4– đồng thời với ion HSO4– và một lượng lớn ion H+. Do đó nồng độ axit chỉ cần duy trì vừa đủ sao cho pH<0 là được, cao quá sẽ không có lợi cho quá trình. Mặt khác không nên trộn thêm axit H2SO4 vào HCl vì sẽ tăng lượng ion HSO4– gây bất lợi cho chuyển dịch cân bằng về phía hòa tan Bi2S3.
Đặc tính hòa tan của Bi2S3 trong HCl hoàn toàn trái ngược với hòa tan Bi2O3 hoặc BiOCl, vì nó theo chiều ngược lại của phản ứng số 11:
BiOCl + 3Cl– + 2H– = BiCl4– + H2O
Trường hợp này nồng độ axit và clo càng cao phản ứng xảy ra càng có lợi.
Có những công trình đã công bố dùng dung dịch H2SO4 với NaCl hoặc HCl đậm đặc tới 6N để hòa tách quặng có chứa khoáng Bi2S3 [7], điều này có thể tác giả chưa tối ưu hóa được các điều kiện cho quá trình.
+ Ảnh hưởng của ion clo: Nhìn vào phản ứng số13, rõ ràng là tăng nồng độ ion clo thúc đẩy phản ứng xảy ra tạo thành BiCl4–. Nhưng muốn tăng ion clo không nên tăng nồng độ HCl (vì làm tăng nồng độ axit) mà bằng cách khác: cho thêm NaCl. Một chất khác cũng rẻ tiền, vừa tăng ion clo, vừa là chất oxy hóa, đó là FeCl2 (khả năng oxy hóa của Fe2+/Fe3+ biểu diễn trên đường 23)
– Do hạn chế về thời gian và nội dung bài viết, nghiên cứu này chỉ đề cập đến các chất có hoạt độ bằng 1.
4. KẾT LUẬN
Xây dựng giản đồ E-pH hệ 5 nguyên là công việc rất phức tạp, đòi hỏi nhiều thời gian và tính kiên trì. Các tác giả đã tìm ra giải pháp rất có hiệu quả và chính xác, áp dụng để xây dựng thành công giản đồ này.
Giản đồ E-pH hệ Bi-S-Cl-H2O xây dựng được là cơ sở lý thuyết cho nghiên cứu xử lý tinh quặng bis- mut sunfua (Bi2S3).
Trên cơ sở giản đồ trạng thái hệ Bi-S-Cl-H2O xây dựng được, đã làm sáng tỏ các vân đề sau:
– Bi2S3 hòa tan được trong axit HCl, khi hòa tan ra, bismut tồn tại ưu tiên ở dạng ion BiCl4–.
– Cơ chế và tác dụng của chất oxy hóa như O2, H2O2 và Fe2+.
– Có thể thúc đẩy quá trình hòa tan bằng cách tăng nồng độ ion clo, điều chỉnh nồng độ axit hợp lý, không nên cho thêm axit sunfuaric.
TÀI LIỆU TRÍCH DẪN
- Http://www.infomine.com/index/pr/Pa212888.PDF, Tiberon releases Nui Phao feasibility study results
- M. Pourbaix, Atlas of electrochemical equilibra, Pergamon Press, 1966
- Nguyễn Kim Thiết, Chương trình tính nhiệt động học, lưu tại Bộ môn Vật liệu kim loại màu và compozit, trường Đại học Bách khoa Hà Nội, 2000
- Nguyễn Kim Thiết, Đặng Văn Hảo, Trần Viết Thường, ứng dụng giản đồ trạng thái E – pH trong luyện kim, Tạp chí nghiên cứu khoa học kỹ thuật và công nghệ quân sự, Số 25, (2008), trang 83 – 86.
- Wiley Blackwell (John Wiley & Sons), The Chemistry of Organic Compounds of Arsenic, Antimony and Bismuth, 1966
- Fathi Habashi, Handbook of Extractive Metallurgy, Tom 2, p.847 WILEY-VCH. Weinheim Chichester New York – Toronto – Brisbane – Singapore, 1997
- E.H. Гразов, Биcмут, Тащкент, 1969
