Bài báo này phân tích tại sao phải lựa chọn phương pháp hóa rắn và chọn phương pháp chế tạo cacbonat bazo niken làm nguyên liệu phục vụ cho điện phân niken…
Research selected additional ion nickel for electrolytic nickel recovery
Ngô Huy Khoa*, Phạm Đức Thắng*, Nguyễn Sơn Lâm**
* Viện Khoa học Vật liệu, Viện Hàn lâm Khoa học và Công nghệ Việt Nam
** Trường Đại học Bách Khoa Hà Nội
Email: khoanh@ims.vast.ac.vn
Ngày nhận bài: 8/11/2015, Ngày duyệt đăng: 25/1/2016
TÓM TẮT
Quá trình hòa tan sten niken sau thiêu sunfat hóa thường được dung dịch niken nồng độ thấp dưới 20 g/l. Sau đó dung dịch này tiếp tục bị khử tạp chất thường là đồng, sắt, crom làm cho dung dịch bị loãng, nồng độ dưới 15 g/l. Muốn điện phân thu hồi niken kim loại thì chúng ta buộc phải hóa rắn niken làm nguyên liệu bổ sung ion niken phục vụ cho quá trình điện phân. Bài báo này phân tích tại sao phải lựa chọn phương pháp hóa rắn và chọn phương pháp chế tạo cacbonat bazo niken làm nguyên liệu phục vụ cho điện phân niken. Vấn đề nghiên cứu này hoàn toàn mới cho đến hiện nay vẫn chưa có nghiên cứu nào trên thế giới.
Từ khóa: điện phân niken, dung dịch niken, cacbonat bazo niken.
ABSTRACT
The process of dissolving nickel mattes residue after burning and often sulfated solution nickel concentration below 20 g/l. Then this solution further reduced impurities usually copper, iron, chromium makes the solution is diluted, the concentration below 15 g/l. Want electrolytic nickel metal recovery, we must solidified nickel as nickel ion additional materials serve electrolysis process. This paper analyzes how to choose the method of solid and fab- rication method selected nickel carbonate as base materials for the electrolytic nickel.
Keywords: electrolytic nickel, nickel solution, nickel carbonate base
I. Đặt vấn đề
Trong quá trình điện phân niken kim loại bằng phương pháp điện phân anốt trơ, nồng độ các ion kim loại chính bị giảm đi theo thời gian quá trình điện phân thu hồi cũng kém hiệu quả. Để quá trình điện phân muốn được ổn định thì cần phải bổ sung nguyên liệu ion kim loại theo các phương pháp sau:
– Bổ sung nguyên liệu bằng dung dịch điện phân có nồng độ cao. Điển hình của phương pháp này là quá trình điện phân kết hợp với quá trình chiết tuần hoàn: Dung dịch sau điện phân sẽ được hòa trộn với dung dịch niken khác sau đó chiết để thu được dung dịch có nồng độ cao (đủ tiêu chuẩn làm dịch điện ly) rồi cấp trở lại bể điện phân. Tuy nhiên, trở ngại của phương pháp này là điều kiện chiết niken ở độ pH cao xấp xỉ 6, trong khi điện phân niken lại cần duy trì độ pH < 3. Việc điều chỉnh pH ở cả 2 công đoạn như vậy là không hiệu quả về mặt kinh tế.
– Bổ sung nguyên liệu cho điện phân bằng các hợp chất dễ hòa tan trong môi trường axit. Quá trình bổ sung ion kim loại được thực hiện thông qua việc hòa tan muối, hyđrôxit hoặc ôxit dễ tan của kim loại thu hồi trong dung dịch điện phân nhằm bổ sung kịp thời ion kim loại để có thể duy trì nồng độ cần thiết cho điện phân. Đây là phương pháp thông dụng trong điện phân thu hồi niken.
Thông thường dung dịch điện phân trực tiếp phải có nồng độ khoảng 150 đến 250 g/l là hợp lý [2]. Trong khi đó dung dịch niken sơ cấp đã được khử sạch tạp chất sắt và đồng thường có nồng độ ion niken khoảng 7-10 g/l. Bởi vậy, bắt buộc phải kết tủa ion niken trong dung dịch này thành ôxit hoặc muối cacbonat bazơ rồi hòa tan lại để thu được dung dịch niken thứ cấp mới với nồng độ ion niken tăng cao đủ tiêu chuẩn điện phân như đã nêu.
II- Phương pháp kết tủa ion niken
Hóa rắn dung dịch niken thực chất là kết tủa ion niken bằng các chất kiềm hệ hyđrôxit hoặc hệ cacbonat. Chất kiềm phổ biến và hợp lý nhất ở dạng công nghiệp là NaOH, Na2CO3, NaHCO3, ngoài ra còn có các hyđrôxit, các muối cacbonat, clorua của các hệ kiềm Ca, K,…. Tuy nhiên, việc lựa chọn các hệ kiềm để nghiên cứu và đảm bảo tính thực tiễn có thể áp dụng vào sản xuất thì các hệ kiềm này phải đảm bảo hai yếu tố:
– Thứ nhất: Tính công nghệ. Nếu lựa chọn các hệ kiềm muối Ca, Mg,…, hoặc hệ muối clorua,.. sẽ rất khó tách các tạp chất muối sunfat dễ kết tủa của Ca, và hệ muối clorua ảnh hưởng không tốt đối với quá trình điện phân bởi sinh ra khí rất độc hại và có nguy cơ phản ứng với anốt. Ngoài ra còn phải tính tới các hệ kiềm này phải đủ mạnh để kết tủa nhanh niken, các hệ kiềm mạnh này phổ biến là Na2CO3 và NaOH.
– Thứ hai: Tính kinh tế. Các hệ kiềm của các muối không phải của Na thường đắt hơn nhiều so với hệ kiềm muối Natri. Vì vậy trong nghiên cứu này chúng tôi lựa chọn hệ kiềm của Natri.
Hệ kiềm của muối natri phổ biến là xút và soda, trong nghiên cứu của chúng tôi lựa chọn hai hệ kiềm này, tương ứng với hai hệ kiềm này ta thu được hai loại nguyên liệu là niken hiđrôxit và niken cacboanat bazo.
Phản ứng hóa học xảy ra khi hóa rắn bằng xút:
NiSO4 + 2NaOH → Na2SO4 + Ni(OH)2 (1)
Phản ứng xảy ra khi hóa rắn bằng soda:
(n+1) Na2CO3 + (n+1) NiSO4 + n H2O = NiCO3.nNi(OH)2 ↓ + (n+1) Na2SO4 + nCO2 ↑ (2)
III. Lựa chọn nguyên liệu bổ sung cho dung dịch điện phân
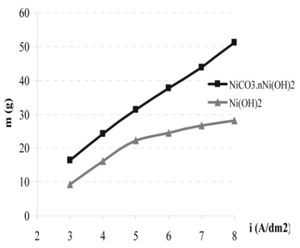
Mục II đã phân tích lựa chọn hai hợp chất quan trọng có thể làm nguyên liệu cung cấp cho quá trình điện phân niken đó là Ni(OH)2 và NiCO3.nNi(OH)2. Hợp chất NiCO3.nNi(OH)2 được gọi là cacbonat bazo niken và nó có nhiều dạng liên kết phân tử khác nhau nhưng trong tự nhiên thường tồn tại ở dạng hợp chất có công thức phân tử là 2NiCO3.3Ni(OH)2.4H2O [4]. Tuy nhiên, để lựa chọn chất nào tốt hơn thì ta phải nghiên cứu điện phân niken với nguồn cung cấp là hai hợp chất này, từ đó có thể so sánh hiệu quả để lựa chọn. Đầu tiên chúng tôi tiến hành điện phân dung dịch niken với nguồn cấp ion Ni2+ là hai loại hợp chất trên và ổn định độ pH. Để kiểm chứng xem ảnh hưởng của chúng đến năng suất điện phân cần tiến hành thực nghiệm trong điều kiện sau: Điện phân với mật độ dòng khác nhau và duy trì độ pH của dung dịch 3 bằng hai nguyên liệu đã điều chế ở trên. Sau cùng thời gian 10 h các mẫu được cân xác định khối lượng; các số liệu được trình bày trên bảng 1 và được biểu diễn trên đồ thị ở hình 1 dưới đây.
Bảng 1: Lượng niken kết tủa (g/dm2) catôt phụ thuộc vào nguồn cấp nguyên liệu và mật độ dòng (A/dm2)
| Nguyên liệu | Mật độ dòng, A/dm2 | |||||
| 3 | 4 | 5 | 6 | 7 | 8 | |
| NiCO3.nNi(OH)2 | 16,3 | 24,3 | 31,4 | 37,6 | 43,8 | 51,1 |
| Ni(OH)2 | 9,4 | 16,2 | 22,3 | 24,4 | 26,7 | 28,2 |
Căn cứ vào bảng 1 và hình 1 ta thấy nguyên liệu từ cacbonat bazơ niken cho phép điện phân với năng suất cao hơn hẳn nguyên liệu từ hyđrôxit niken, và khối lượng niken điện phân cũng hoàn toàn tuân theo định luật Faraday. Điều này có thể giải thích như sau: Khi được bổ sung vào dung dịch điện phân cacbonat bazơ niken được hoà tan bởi axit sulfuric dư có tạo ra khí CO2 thành bọt thoát khí thoát lên trên như phương trình.
NiCO3.nNi(OH)2 + (n+1)H2SO4 = (n+1)NiSO4 + (n+1)H2O + CO2 ↑ (3)
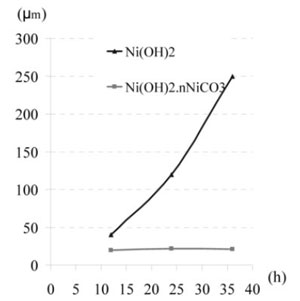
Khi phản ứng này xảy ra bọt khí này thoát lên mãnh liệt (khiến từng mảng nhỏ muối cacbonat niken bị xé nhỏ, nở phồng giảm tỷ trọng và trôi nổi trên bề mặt dung dịch) vô tình làm khuấy trộn dung dịch, nhờ đó góp phần làm giảm phân cực nồng độ, tạo điều kiện cho quá trình phóng điện của ion niken và kết tủa lên catôt được thuận lợi. Còn hydroxyt niken khi tham gia phản ứng không tạo ra pha khí nên không xảy ra quá trình khuấy trộn tự nhiên này, không cải thiện được phân cực nồng độ, sự phóng điện của ion niken và kết tủa lên catôt bị ức chế làm cho năng suất bị thấp hơn hẳn (khoảng 30 – 40%) so với trường hợp kia. Chính quá trình khuấy trộn tự nhiên không được cải thiện nên nếu dùng hydroxyt niken làm nguyên liệu bổ sung ion niken thì tấm màng niken catot không được đồng đều về độ dày, phía trên mỏng hơn còn vùng dưới lại dày hơn, điều này thể hiện rõ trên hình 2.
Điều này chứng tỏ rằng ban đầu hyđrôxit niken vào bể nó nặng và chìm xuống đáy, sau đó xảy ra phản ứng hoà tan niken làm cho mật độ Ni2+ lớp đáy cao hơn lớp trên bởi quá trình chậm khuếch tán, hơn nữa chính bản thân niken là kim loại nặng cho nên khả năng khuếch tán tự nhiên của nó càng kém, điều này đã làm cho độ dày của tấm màng niken catôt không đồng đều theo chiều cao của lớp bể điện phân. Đặc biệt khi tăng mật độ dòng, mối quan hệ giữa lượng niken kết tủa với mật độ dòng càng không tuân theo định luật Faraday vì chế độ khuếch tán không có sự khuấy trộn càng không thể bảo đảm cung cấp đủ ion niken Ni2+ cho quá trình phóng điện trên catôt và đây là hiệu quả của sự phát sinh phân cực khuếch tán do chậm cung cấp ion niken.
Ngoài ra còn một lý do khác nữa để giải thích hiện tượng điện phân bằng muối cacbonat bazo tốt hơn so với niken hyđrôxit, đó là:
– Nếu điện phân bằng muối cacbonat bazo niken thì phân tử muối này có chứa gốc CO3 nên khi nó vào trong bể điện phân thì phân tử này sẽ sủi bọt và dễ dàng xé nhỏ thành các phần nhỏ để rồi nó luôn luôn nổi lên trên bề mặt bể điện phân. Nhờ vậy các gốc hyđrôxit phản ứng thuận lợi với axit trong bể điện phân thành ion niken.
![Hình 3: Giản đồ trạng thái E-pH của Ni ở 250C [3]](https://www.jstmetal.com/wp-content/uploads/2017/12/h3-dienphan_Niken.jpg)
+ Quá trình hòa tan hyđrôxit niken làm giảm nồng độ axit và bổ sung ion niken cho dung dịch điện phân:
Ni(OH)2 + H2SO4 = NiSO4 + 2H2O (4)
+ Đầu tiên các hyđrôxit niken này trôi nổi bám vào bề mặt anot, tại đây quá trình phóng điện bắt đầu xảy ra. Theo giản đồ thế điện cực hình 2 ta dễ dàng thấy rằng thế điện cực của Ni(OH)2 nhỏ hơn nhiều so với thế điện cực của OH–. Vì vậy Ni(OH)2 dễ dàng phóng điện tử theo phản ứng:
Sản phẩm Ni3O4 hình thành tiếp tục phóng điện
3Ni(OH)2 = 2e– + 2H+ + 2H2O + Ni3O4 (5)
do thế điện cực của oxit này nhỏ hơn của OH:
H2O + 2 Ni3O4 = 2e– + 2 H+ + 3Ni2O3 (6)
Do thế điện cực của Ni2O3 luôn luôn xấp xỉ với thế điện cực của OH– nên oxit Ni2O3 này còn có thể tiếp tục phóng điện để tạo thành ôxit NiO2 bền hơn:
H 2O + Ni2O3 = 2e– + 2H+ + 2 NiO2
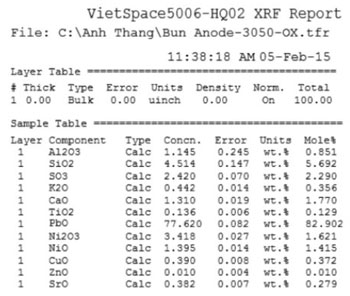
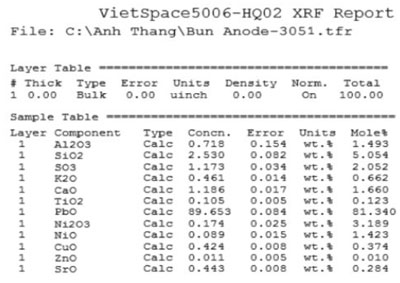
Vì vậy, sản phẩm cuối cùng của chuỗi phản ứng này có thể gồm Ni2O3 và NiO2. Các sản phẩm này tạo thành bùn lắng xuống đáy anot tạo thành bùn dương cực, để minh chứng cho điều này chúng tôi đã lấy bùn anôt mang đi phân tích X-RAY, kết quả phân tích thể hiện trên hình 4 và hình 5 cho thấy bùn dương cực của mẻ điện phân thí nghiệm đối với nguồn nguyên liệu cấp vào là Ni(OH)2 rõ ràng có tồn tại ôxit niken, trong khi đó nếu điện phân bằng muối NiCO3.nNi(OH)2 ôxit niken tồn tại với tỷ lệ thấp hơn nhiều. Kết quả phân tích X-RAY thể hiện trên hình 4 cho thấy trong thành phần cặn bùn anôt rõ ràng có thành phần niken hàm lượng lên đến 1,49%. Kết quả phân tích càng giải thích chỉ rõ ở mật độ dòng cao 8 A/dm2, nguồn nguyên liệu cấp Ni(OH)2 thì khối lượng kim loại thu được lại càng ít (28,2 g) so với nguồn nguyên liệu cấp cacbonat bazo niken (51,1 g).
Từ kết quả thực nghiệm trên, có thể thấy rằng sử dụng muối cacbonat bazơ niken NiCO3.nNi(OH)2 làm nguyên liệu cấp ion Ni2+ cho quá trình điện phân niken là thích hợp hơn cả. Muối cacbonat- bazo niken cho lượng niken kết tủa lớn hơn hẳn so với việc sử dụng muối bazo niken, nhờ vậy mà có thể giảm được tiêu hao điện năng, thời gian điện phân, nâng cao năng suất và cải thiện sự đồng đều bề mặt của tấm màng niken điện phân trên điện cực trơ.
IV. Kết luận
– Để có được dung dịch điện ly đủ nồng độ cho điện phân thì cần điều chế bằng cách hòa tan trong axit sunfuric đặc Ni(OH)2 hoặc NiCO3.nNi(OH)2 thu được từ hóa rắn dung dịch sunfat niken sơ cấp.
– Kết quả điện phân niken bằng hai nguồn nguyên liệu cung cấp là Ni(OH)2 và NiCO3.nNi(OH)2 cho thấy điện phân bằng NiCO3.nNi(OH)2 có hiệu suất cao hơn và không còn hiện tượng sinh ôxit niken ở bùn anôt. Vì vậy hợp chất cacbonat bazo niken NiCO3.nNi(OH)2 thu được khi hóa rắn dung dịch niken sơ cấp bằng soda là nguyên liệu thích hợp để bổ sung ion niken cho bể điện phân thu hồi niken
TÀI LIỆU THAM KHẢO
- Đào Ngọc Nhiệm – Nghiên cứu quy trình công nghệ chiết thu hồi kim loại màu – Báo cáo đề tài cơ sở Viện Khoa học Vật liệu – 2014.
- Phạm Đức Thắng – Nghiên cứu công nghệ xử lý và tái sử dụng bã thải rắn trong công nghiệp mạ crom, niken – Báo cáo tổng kết đề tài cấp Viện Hàn lâm Khoa học và Công nghệ Việt Nam – 2008.
- Pourbaix M – Atlats of electrochemical equilibra. Pergamon Press, 1966.
- http://bio-kem.hu/en/inorganic-metal-fine-chemicals.html
